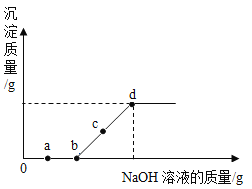
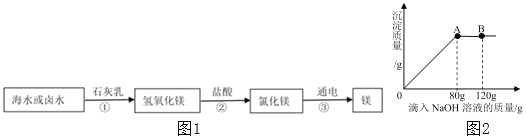
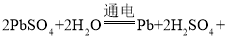题目内容
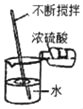
【题目】同学们利用自制仪器模拟工业炼铁实验,用下图所示微型实验装置制取CO,然后用CO还原Fe3O4并检验气体产物。已知甲酸(HCOOH)具有挥发性,在热的浓硫酸中分解生成一氧化碳和水。
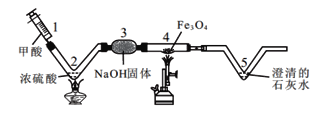
(1)位置4发生的化学方程式是___________________。
(2)本实验存在一处明显缺陷,请给出优化建议______________(写出一点即可)。
(3)位置5处观察到的实验现象是_____________________。
【答案】Fe3O4+4CO![]() 3Fe+4CO2 在位置5的末端放置一盏点燃的酒精灯 澄清石灰水变浑浊
3Fe+4CO2 在位置5的末端放置一盏点燃的酒精灯 澄清石灰水变浑浊
【解析】
装置图将1中的甲酸注入到加热的浓硫酸2中,甲酸分解生成一氧化碳和水。而甲酸也具有挥发性,故采用3中的氢氧化钠来吸收水和挥发的甲酸,得到较纯净的一氧化碳进入到4中与四氧化三铁发生反应,把铁给还原出来,剩余的一氧化碳气体和还原后的产物二氧化碳进入到5中,二氧化碳使得澄清石灰水变浑浊。一氧化碳从5出去后直接排道空气中,会污染空气。
(1)由装置分析得:位置4发生是四氧化三铁与一氧化碳反应生成二氧化碳和铁单质,其化学方程式是:Fe3O4+4CO![]() 3Fe+4CO2;故填:Fe3O4+4CO
3Fe+4CO2;故填:Fe3O4+4CO![]() 3Fe+4CO2
3Fe+4CO2
(2)本实验存在一处明显缺陷,是没有进行尾气处理,处理的建议是:在5的末端放置一盏点燃的酒精灯。故填:在位置5的末端放置一盏点燃的酒精灯
(3)由装置分析得:位置5处是二氧化碳和澄清石灰水反应生成碳酸钙和水,故可观察到的实验现象是:澄清石灰水变浑浊。故填:澄清石灰水变浑浊

【题目】无色液体Ⅹ是下列四种物质中的一种。将其分成等量的三份,向其中分别加入少量的氯化铵溶液、碳酸钠溶液、酚酞试液,产生的现象如下表。则X是下列选项中的( )
加入物质 | 氯化铵溶液 | 碳酸钠溶液 | 酚酞试液 |
现象 | 产生无色气体 | 产生沉淀 | 变成红色 |
A. NaOH溶液B. ![]() 溶液C. NaCl溶液D.
溶液C. NaCl溶液D. ![]() 溶液
溶液