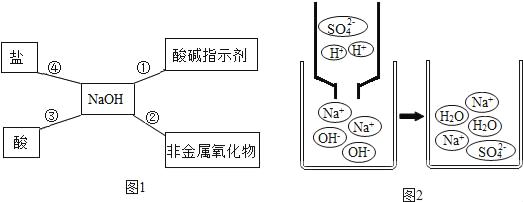
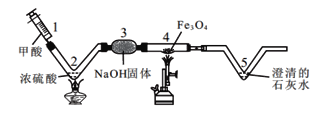
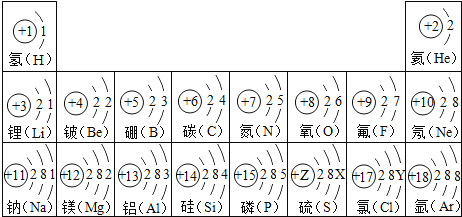
题目内容
【题目】由两种金属组成的混合物共40g,与足量稀盐酸充分反应后,共放出2g氢气。则原混合物的组成不可能是( )
A. Zn和FeB. Fe和MgC. Zn和MgD. Al和Cu
【答案】A
【解析】
根据与硫酸反应时铁、锌、镁、铝分别呈+2、+2、+2、+3价,与足量稀盐酸反应后生成了2g氢气,所需要消耗金属的质量分别为:需要金属铁的质量=![]() ;需要金属锌的质量=
;需要金属锌的质量=![]() ;需要金属镁的质量=
;需要金属镁的质量=![]() ;需要金属铝的质量=
;需要金属铝的质量=![]() ;铜不与稀硫酸反应。根据金属混合物与酸反应产生气体质量为两种金属反应产生氢气质量和,由实际实验中两种金属混合物40g与足量稀盐酸反应后生成了2 g氢气,可判断混合物中两种金属可能为金属铁、锌两种金属其中之一与金属镁、铝两种金属其中之一所组成的混合物,如Zn和Mg、Fe和Mg、Al和Cu等的组合,而Zn和Fe、所组成的混合物不能满足条件,原混合物的组成不可能是这两个组合。
;铜不与稀硫酸反应。根据金属混合物与酸反应产生气体质量为两种金属反应产生氢气质量和,由实际实验中两种金属混合物40g与足量稀盐酸反应后生成了2 g氢气,可判断混合物中两种金属可能为金属铁、锌两种金属其中之一与金属镁、铝两种金属其中之一所组成的混合物,如Zn和Mg、Fe和Mg、Al和Cu等的组合,而Zn和Fe、所组成的混合物不能满足条件,原混合物的组成不可能是这两个组合。
故选A

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目