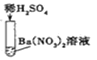题目内容
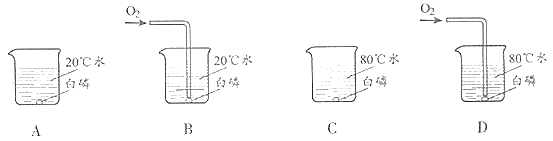
【题目】某化学兴趣小组的同学们在实验室里探究某些酸、碱、盐之间是 否发生复分解反应。
(查阅资料)硫酸钡(BaSO4)白色固体,不溶于水,也不溶于酸。
(实验与探究)
操作 | 现象 | 实验解析 | 结论 | |
实验一 |
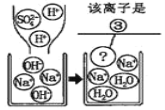
| ①________ | 化学方程式是: K2CO3+H2SO4=K2SO4+H2O+CO2↑ | 生成物中 有气体或 有④____ 或有沉淀 生成时, 复分解反 应可以发 生。 |
实验二 | 适量的稀硫酸
| 溶液颜色 由红色恰 好变为无 色 |
| |
实验三 |
| 产生白色 沉淀 | 该反应的实质是:Ba2++SO42-=BaSO4↓ |
实验三结束后,某同学出于好奇,把实验三试管里的上层清液 a 倒入另一支洁净的试管中,向清液 a 中逐滴滴加 K2CO3 溶液。在滴加过程中,发现先产 生气泡,然后又产生白色沉淀。根据上述现象,请你判断原清液 a 中的溶质是⑤______。
(拓展)将稀盐酸、Ca(OH)2 溶液、NaCl 溶液、Na2CO3 溶液任意两种溶液相 混合,写出能发生反应且有沉淀生成的化学方程式______。
(反思)复分解反应的实质是朝着单位体积内______(填微粒种类 名称)数目减小的方向进行。
【答案】有气泡产生 酚酞 SO42- 水(或 H2O) HNO3 和 Ba(NO3)2(或硝酸和硝酸钡) Ca(OH)2+Na2CO3==CaCO3↓+2NaOH 离子
【解析】
①在液体中产生气体会看到有气泡冒出。
②酚酞遇碱性溶液变红,遇中性或酸性溶液不变色。
③酸碱反应的实质是氢离子与氢氧根离子结合为水,硫酸钠易溶于水,故反应后的粒子还有SO42-。
④复分解反应可以发生的条件是两种化合物互相交换成分后可生成水或气体或沉淀。
⑤![]() ,某同学出于好奇,把实验三试管里的上层清液 a 倒入另一支洁净的试管中,向清液 a 中逐滴滴加 K2CO3 溶液。在滴加过程中,发现先产生气泡,然后又产生白色沉淀。先产生气泡,则原清液 a 中的溶质有HNO3,然后又产生白色沉淀,说明原清液 a 中的溶质有Ba(NO3)2,即原清液 a 中的溶质是HNO3和Ba(NO3)2。
,某同学出于好奇,把实验三试管里的上层清液 a 倒入另一支洁净的试管中,向清液 a 中逐滴滴加 K2CO3 溶液。在滴加过程中,发现先产生气泡,然后又产生白色沉淀。先产生气泡,则原清液 a 中的溶质有HNO3,然后又产生白色沉淀,说明原清液 a 中的溶质有Ba(NO3)2,即原清液 a 中的溶质是HNO3和Ba(NO3)2。
[拓展]碳酸钙是白色难溶于水的固体物质,故反应的化学方程式为:Ca(OH)2+Na2CO3==CaCO3↓+2NaOH
[反思]根据以上探究可知,复分解反应的实质是朝着单位体积内离子数目减小的方向进行。

【题目】据统计,我国每年报废的手机超过1亿部,若不进行有效回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。

(提出问题)从废旧手机中可以回收到哪些有价值的金属?如何回收?
(查阅资料)
i.手机电路板中的金属及其价格如下表所示:
种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
市场价格($/t) | 365 | 7175.5 | 1710.5 | 14235 | 4.7×107 | 7.6×105 | 2.7×107 |
矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
ii.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后;NiCl2溶液为绿色。
Iii.2Cu+O2+2H2![]() 2CuSO4+2H2O
2CuSO4+2H2O
(实验方案)
第一步:选择值得回收的金属。
依据资料i中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,原因是:①它们的市场价格较高;②_____。
第二步:设计实验分离、回收部分金属。
序号 | 实验步骤 | 实验现象 |
I | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
II | 将金属电路放入烧杯中,加入足量稀盐酸浸泡 | _____ |
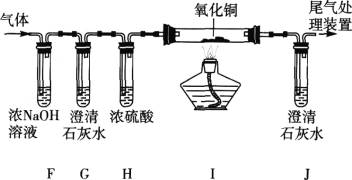
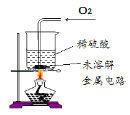
III | 取II中未溶解的金属电路,用蒸馏水洗净后,放入如图所示装置中,进行实验。
| 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
IV | 过滤III中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
V | _____ | 得到红色固体 |
(问题讨论)
(1)由步骤I中的现象,可推知的焊锡的物理性质是_____。
(2)步骤II对应的实验现象是_____。
(3)步骤II所得溶液中,一定含有的金属元素是_____。
(4)步骤V的操作是_____。
(反思交流)
为了确认步骤IV中滤纸上的金属成分,应进一步查阅的资料为_____。