题目内容
【题目】如图为KNO3和NaCl两种物质的溶解度曲线。
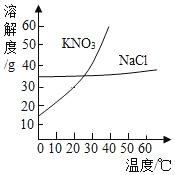
(1)在溶质的质量和质量分数不变的条件下,将40℃接近饱和的KNO3溶液转化为饱和溶液,应采用的方法是_____;
(2)20℃时,将40克KNO3放入100克水中,充分溶解后还剩8.4克KNO3,则20℃时的KNO3溶解度为_____g。
(3)若NaCl溶液中混有少量的KNO3,提纯NaCl的方法是_____。
【答案】降低温度 31.6 蒸发结晶
【解析】
(1)在溶质的质量和质量分数不变的条件下,将40℃接近饱和的KNO3溶液转化为饱和溶液,应采用的方法是:降低温度;
(2)固体溶解度的概念是指在一定的温度下,某物质在100克溶剂里达到饱和状态时所溶解的质量。20℃时的KNO3溶解度=40g-8.4g=31.6g;
(3)根据题目信息和溶解度曲线可知:KNO3和NaCl两种固体物质的溶解度,都是随温度升高而增大,而硝酸钾的溶解度随温度的升高变化比氯化钠大。若NaCl溶液中混有少量的KNO3,提纯NaCl的方法是蒸发结晶。

【题目】化学研究性学习小组同学取 10g 石灰石样品,用足量的稀盐酸测定石灰石中碳酸钙的质量分数(假设石灰石中杂质不与盐酸反应)。测量 5 分钟内生成 CO2 质量的数据如表:
时间/分钟 | 1 | 2 | 3 | 4 | 5 |
生成 CO2 的质量/g | 1.5 | 2.5 | 3.0 | 3.3 | 3.3 |
请回答下列问题:
(1)石灰石中的 CaCO3 完全反应时,生成二氧化碳气体的物质的量为_____mol。
(2)该石灰石中 CaCO3 的质量分数是多少?(根据化学方程式列式计算)_____。
(3)请根据表中数据分析,你能发现数据背后的化学反应规律是_____。
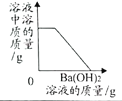
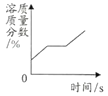
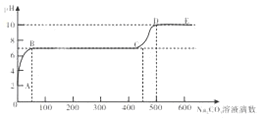
【题目】下列图像分别表示4个实验的过程中,其中图像与对应实验相符合的是
|
|
|
|
A.向一定质量稀H2SO4中加入Ba(OH)2至恰好中和 | B.将一定质量的不饱和KNO3溶液恒温蒸发至有晶体析出 | C.向等质量的金属Fe和Zn中分别加入等浓度的稀盐酸 | D.CuO和C的固体混合物在高温下反应 |
A. AB. BC. CD. D
【题目】下列实验操作和现象能得出相应结论的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向收集满CO2的软塑料瓶中加入约 | 塑料瓶变瘪 | CO2能与食盐反应 |
B | 点燃从导管放出的某气体,在火焰上方罩一个冷而干燥的烧杯 | 烧杯内壁有无色液滴产生 | 被点燃的气体一定是H2 |
C | 50℃时,将19g KCl固体加入50g蒸馏水中,完全溶解后缓慢降温 | 降温至20℃时开始有晶体析出 | 20℃时,KCl的溶解度为19g |
D | 将白磷浸没在热水中,再向热水中的白磷通氧气 | 通氧气前白磷不燃烧,通氧气后白磷燃烧 | 氧气是可燃物燃烧的条件之一 |
A. AB. BC. CD. D