��Ŀ����
����Ŀ��С��ͬѧ�Ѻ�ɫ������ͭ��ĩ���ɫ��ľ̿�۾��Ȼ�Ϻ����Թ��ڼ��ȵ����£���ַ�Ӧ���Թ��ڳ��к�ɫ���ʲ����⣬���к�ɫ���������
[�������]���ɫ���������ʲô���ʣ�
[���������]
��1�����������̼��
��2�����������_____��
��3�����������̼������ͭ�Ļ���
[������ʵ��]��
��1������ʵ�鷢����Ӧ�Ļ�ѧ����ʽΪ_____
��2��С��ͬѧ��Ϊ���루3�������ų�������������_____
��3��С��������¼�ʵ����У������С����д�±�
ʵ����� | ʵ������ | ���� |
ȡ������ɫ������� ������ϡ���� | ��_____ | ���루1����ȷ |
��_____ | ���루2����ȷ |
��4��С�����ͭ���е�ľ̿��ȥ��ô�����ͭ�ۣ��������Ѹû��������ڿ��������գ���������ʵ���ܷ�ɹ���Ϊʲô��_____��
���𰸡�����ͭ ![]() ̼������ͭҪ��Ӧ������ͬʱ���� ���������� ��ɫ�������ܽ⣬��Һ����ɫ��Ϊ��ɫ ���ܣ�ͭҪ�������������Ӧ
̼������ͭҪ��Ӧ������ͬʱ���� ���������� ��ɫ�������ܽ⣬��Һ����ɫ��Ϊ��ɫ ���ܣ�ͭҪ�������������Ӧ
��������
��������裺
��2����ַ�Ӧ���Թ��ڳ��к�ɫ���ʲ����⣬���к�ɫ�����������������ͭ��̼�۶��Ǻ�ɫ�ģ������������ʶ��п���ʣ�࣬���Բ���������������ͭ��
������ʵ�飺
��1������ͭ��̼�ڸ���������ͭ�Ͷ�����̼������ʽΪ��![]()
��2��С��ͬѧ��Ϊ���루3�������ų�������������̼������ͭ�ܷ�Ӧ������ͬʱ���ڣ�
��3�����ڲ��루1����ȷ����˺�ɫ������̼��̼��ϡ���᳣���²���Ӧ����������������루2����ȷʱ����ɫ����������ͭ������ͭ��ϡ���ᷴӦ��������ͭ��ˮ�����ʵ�������ǣ���ɫ�������ܽ⣬��Һ����ɫ��Ϊ��ɫ��
��4����Ϊ�ȵ�ͭ�Ϳ����е������ܹ���Ӧ��������ͭ�����Բ���ͨ�����ճ�ȥͭ���е�̼�ۡ�

 ��ǰ����ϵ�д�
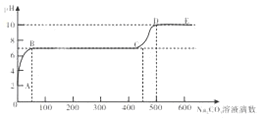
��ǰ����ϵ�д�����Ŀ����ѧ�о���ѧϰС��ͬѧȡ 10g ʯ��ʯ��Ʒ����������ϡ����ⶨʯ��ʯ��̼��Ƶ���������������ʯ��ʯ�����ʲ������ᷴӦ�������� 5 ���������� CO2 ���������������
ʱ��/���� | 1 | 2 | 3 | 4 | 5 |
���� CO2 ������/g | 1.5 | 2.5 | 3.0 | 3.3 | 3.3 |
��ش��������⣺
��1��ʯ��ʯ�е� CaCO3 ��ȫ��Ӧʱ�����ɶ�����̼��������ʵ���Ϊ_____mol��
��2����ʯ��ʯ�� CaCO3 �����������Ƕ��٣������ݻ�ѧ����ʽ��ʽ���㣩_____��
��3������ݱ������ݷ��������ܷ������ݱ���Ļ�ѧ��Ӧ������_____��
����Ŀ������ʵ������������ܵó���Ӧ���۵��ǣ�������
ѡ�� | ʵ����� | ���� | ���� |
A | ���ռ���CO2��������ƿ�м���Լ | ����ƿ��� | CO2����ʳ�η�Ӧ |
B | ��ȼ�ӵ��ܷų���ij���壬�ڻ����Ϸ���һ�����������ձ� | �ձ��ڱ�����ɫҺ�β��� | ����ȼ������һ����H2 |
C | 50��ʱ����19g KCl�������50g����ˮ�У���ȫ�ܽ�������� | ������20��ʱ��ʼ�о������� | 20��ʱ��KCl���ܽ��Ϊ19g |
D | ������û����ˮ�У�������ˮ�еİ���ͨ���� | ͨ����ǰ���ײ�ȼ�գ�ͨ���������ȼ�� | �����ǿ�ȼ��ȼ�յ�����֮һ |
A. AB. BC. CD. D