题目内容
【题目】(1)如图是甲、乙、丙三种固体物质的溶解度曲线,回答问题:
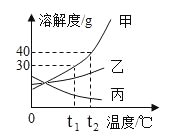
① t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序是:________________;
② t2℃时,将 45g 甲加入到 50g 水中,充分溶解,所得溶液的质量为________________g;
③要使 t1℃时,接近饱和的乙溶液变成该温度下的饱和溶液,可采取的方法是____________(写一种即可)。
④将 t2℃时丙物质的饱和溶液降温到 t1℃,此时该溶液的溶质质量分数____________(填“变大”、“变小”或者“不变”)。
(2)配置溶质质量分数为 12%的氯化钠溶液 60g,有以下操作。
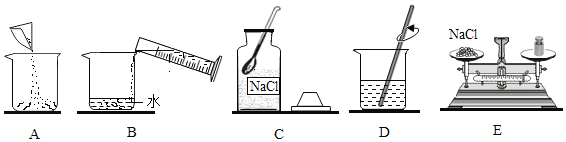
①配置该溶液的正确操作顺序为:________________(填字母序号)。
②在配置该溶液的过程中玻璃棒的作用:________________。
③已知 20℃时氯化钠的溶解度为 36.0g,现在有 20℃的溶质质量分数为 24%的氯化钠溶液,此时该溶液为________________溶液(填“饱和”或“不饱和”)。
【答案】甲>乙>丙 70g 增加溶质(或减少溶剂) 不变 CEABD 搅拌,加速氯化钠溶解 不饱和
【解析】
(1)①在溶解度曲线图上,横坐标是温度,纵坐标是溶解度。 t1℃时,甲、乙、丙三种物质溶解度由大到小的顺序是:甲>乙>丙;
② t2℃时,甲的溶解度为40g,即在t2℃时,100g水中最多溶解40g甲,将 45g 甲加入到 50g 水中,充分溶解,能溶解20g的甲,所得溶液的质量为70g;
③饱和溶液是在一定温度下、一定量的溶剂里不能再溶解某物质的溶液叫该物质的饱和溶液,反之为不饱和溶液。要使 t1℃时,接近饱和的乙溶液变成该温度下的饱和溶液,可采取的方法是增加溶质(或减少溶剂);
④将 t2℃时丙物质的饱和溶液降温到 t1℃,丙的溶解度变大,溶质、溶剂的量都不变,此时该溶液的溶质质量分数不变;
(2)①配制溶液的正确操作步骤为计算、称量、溶解、装瓶存放,所以操作顺序为:CEABD;
②在配制该溶液的过程中玻璃棒的作用:搅拌,加速氯化钠溶解;
③已知 20℃时氯化钠的溶解度为 36.0g, 20℃时氯化钠饱和溶液的溶质质量分数为![]() > 24%,24%的氯化钠溶液,为不饱和溶液。
> 24%,24%的氯化钠溶液,为不饱和溶液。