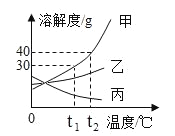
题目内容
【题目】为了测定一瓶硫酸铜溶液的溶质质量分数,取出50g该溶液,向其中逐滴加入溶质质量分数为10%的氢氧化钠溶液,反应过程中生成沉淀的质量与所用氢氧化钠溶液质量的关系如图所示:请你仔细分析此关系图,并进行计算。
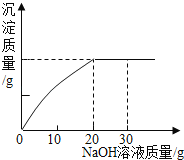
(1)当滴入氢氧化钠溶液_____g时,硫酸铜与氢氧化钠恰好完全反应。
(2)计算此硫酸铜溶液的溶质的质量分数(写出计算过程)。__________________________
【答案】20 8%。
【解析】
(1)由图示可知,当NaOH溶液质量为20g时,沉淀不再生成,说明反应恰好完全;
(2)根据氢氧化钠与硫酸铜反应的化学方程式和氢氧化钠的质量,列出比例式,就可计算出参与反应的CuSO4质量,然后根据质量分数公式计算即可。
解:(1)由图示可知,当NaOH溶液质量为20g时,沉淀不再生成,说明反应恰好完全;
(2)设参与反应的CuSO4质量为x,
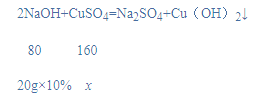
![]()
x=8g,
硫酸铜溶液的溶质的质量分数为:![]() ×100%=16%;
×100%=16%;
答:(1)当NaOH溶液质量为20g时,沉淀不再生成,说明反应恰好完全;
(2)此硫酸铜溶液中溶质的质量分数为16%。

 步步高达标卷系列答案
步步高达标卷系列答案【题目】据央视报道,有不法酒类生产企业在白酒中添加酯类物质以增强口感,下表中是几种常见的酯.
酯的名称 | 甲酸甲酯 | 甲酸乙酯 | 乙酸甲酯 | 乙酸乙酯 | 乙酸丙酯 | 丙酸乙酯 | 丙酸丙酯 |
化学式 | C2H4O2 | C3H6O2 | C3H6O2 | C4H8O2 | C5H10O2 | C5H10O2 | X |
请完成下列问题:
(1)比较归纳是学习化学的重要方法,上述物质的共同特点有______(写出一条即可).
(2)据表推测X的化学式为______.
(3)一个甲酸甲酯分子中含有______个原子.
(4)甲酸甲酯中,碳、氢、氧三种元素的质量比为______(最简整数比).
(5)甲酸甲酯中碳元素的质量分数为______.