题目内容
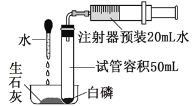
【题目】在一次课外实验探究中,同学们将打磨过的镁条放到装有蒸馏水的试管中,发现镁条表面有极少量气泡(如图)。
(提出问题)产生的气体是什么?
(查阅资料)任意化学反应中,有元素化合价升高,必有元素化合价降低。
(猜想与假设)小红猜:O2:小明猜_____。
(实验1)
实验步骤 | 现象 | 结论 |
往镁与水反应的试管中滴 加2滴无色酚酞溶液 | 镁条附近溶液变红 | 生成了_____ |
请结合以上的探究内容和资料,写出镁与水的反应方程式:_____。
(实验2)同学们又做了镁条与盐溶液反应的实验,实验现象如表:
实验序号 | 实验1 | 实验2 |
与镁反应的试剂 | NaCl溶液 | H2O |
实验现象 | 有较多气泡产生 | 气泡极少 |
表中,用水进行实验的目的是_____,根据表中的实验现象,请设计一个实验方案证明是氯离子(C1﹣)而不是钠离子(Na+)能够加快镁与水的反应速率:_____。
【答案】氢气 氢氧化镁 Mg+2H2O=Mg(OH)2+H2↑ 对比 取两支相同的试管,加入等量、同浓度的氯化钠、硫酸钠溶液,分别将大小相同打磨过的镁条放入试管中,观察发现氯化钠试管中产生气体更快
【解析】
化学反应前后,元素种类不变;
镁和水反应生成氢氧化镁和氢气,氢氧化镁溶于水显碱性,能使酚酞试液变红色;
对比试验要确定好常量和变量。
由质量守恒定律可知,反应物中含有氧元素、氢元素,小红猜:O2:小明猜氢气。
故填:氢气。
[实验1]
往镁与水反应的试管中滴加2滴无色酚酞溶液,镁条附近溶液变红,说明生成了碱氢氧化镁,实验过程如下所示:
实验步骤 | 现象 | 结论 |
往镁与水反应的试管中滴 加2滴无色酚酞溶液 | 镁条附近溶液变红 | 生成了氢氧化镁 |
结合以上的探究内容和资料,镁与水反应生成氢氧化镁和氢气,反应的反应方程式:Mg+2H2O=Mg(OH)2+H2↑。
故填:Mg+2H2O=Mg(OH)2+H2↑。
[实验2]
实验序号 | 实验1 | 实验2 |
与镁反应的试剂 | NaCl溶液 | H2O |
实验现象 | 有较多气泡产生 | 气泡极少 |
表中,用水进行实验的目的是对比,通过对比可知,氯化钠中的钠离子,或氯离子,或钠离子和氯离子能够促进反应进行;
实验方案:取两支相同的试管,加入等量、同浓度的氯化钠、硫酸钠溶液,分别将大小相同打磨过的镁条放入试管中,观察发现氯化钠试管中产生气体更快。
故填:对比;取两支相同的试管,加入等量、同浓度的氯化钠、硫酸钠溶液,分别将大小相同打磨过的镁条放入试管中,观察发现氯化钠试管中产生气体更快。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案