��Ŀ����
����Ŀ����ͼ1��ʾ������������Һ�����ᷴӦ��ʵ���о���
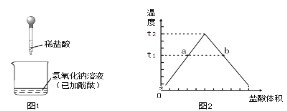
(1)ͼ1�У�֤���������������ᷢ���кͷ�Ӧ��ʵ��������____��
(2)��������ϵ��룬�ձ�����Һ��pH��___(����������������С������������)���÷�Ӧ�Ļ�ѧ����ʽ��___��
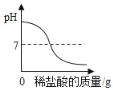
(3)��������ϵ��룬�ձ�����Һ�¶ȱ仯������ͼ2��ʾ���¶������ߺ͵�ԭ����___��
(4)ijʱ�̲����Һ���¶���t1�棬a��b�����Ӧ����Һ�й�ͬ����____(�����)��
(5)���¶�Ϊt2��ʱ��֤����Һ�����������Ƶ�ʵ�鷽����____��
���𰸡���Һ�ɺ�ɫ��Ϊ��ɫ ��С NaOH+HCl=NaCl+H2O �������������ᷢ���кͷ�Ӧ�Ĺ����зų�����������кͷ�Ӧǡ����ɺ�������ɢʧ�������У��ٵμ�ϡ���������˽��µ����� Na+��Cl- ���ձ����ٵμ���������������Һ���۲�˲����Һ��ɫ�仯�����ȱ�죬�����ɫ��֤������û����������
��������
(1)���ڷ�̪��Һ����������Һ���ɺ�ɫ���������Ի�������Һ�б���Ϊ��ɫ������������ϡ���ᷢ���кͷ�Ӧ�����Ȼ��ƺ�ˮ������Һ�ɺ�ɫ��Ϊ��ɫ��˵���������������ᷢ�����кͷ�Ӧ��
(2)���ŵ���ϡ���ᣬ����������ϡ���ᷢ���кͷ�Ӧ�����Ȼ��ƺ�ˮ���÷�Ӧ�Ļ�ѧ����ʽ�ǣ�NaOH+HCl=NaCl+H2O�����������ԣ���������ĵμӣ���Һ�ļ��Լ�����������ǿ��pH��С��
(3)�������������ᷢ���кͷ�Ӧ�Ĺ����зų����������Կ�ʼ�μ�����ʱ�¶����������μ�����һ����ʱ������кͷ�Ӧǡ����ɺ�������ɢʧ�������У��ٵμ�ϡ���������˽��µ����ã�
(4)��ͼ���֪��a��ʱ�μӵ�ϡ����û�н�����������ȫ�кͣ����˿���Һ�Լ��ԣ���Һ�е��������������ƺ��Ȼ��ƣ�b��ʱ���μӵ������Ѿ���������ʱ��Һ�����ԣ���Һ�е��������Ȼ�����Ȼ��ƣ�����a��b�����Ӧ����Һ�й�ͬ���������ӡ������ӣ�
(5)���¶�Ϊt2��ʱ��˵�����кͷ�Ӧǡ����ɣ��������ձ����ٵμ���������������Һ���۲�˲����Һ��ɫ�仯�����ȱ�죬�����ɫ��֤������û���������ơ�

����Ŀ����һ�ο���ʵ��̽���У�ͬѧ�ǽ���ĥ����þ���ŵ�װ������ˮ���Թ��У�����þ�������м��������ݣ���ͼ����
��������⣩������������ʲô��
���������ϣ����⻯ѧ��Ӧ�У���Ԫ�ػ��ϼ����ߣ�����Ԫ�ػ��ϼ۽��͡�
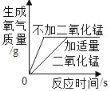
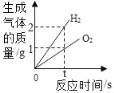
����������裩С��£�O2��С����_____��
��ʵ��1��
ʵ�鲽�� | ���� | ���� |
��þ��ˮ��Ӧ���Թ��е� ��2����ɫ��̪��Һ | þ��������Һ��� | ������_____ |
�������ϵ�̽�����ݺ����ϣ�д��þ��ˮ�ķ�Ӧ����ʽ��_____��
��ʵ��2��ͬѧ��������þ��������Һ��Ӧ��ʵ�飬ʵ�����������
ʵ����� | ʵ��1 | ʵ��2 |
��þ��Ӧ���Լ� | NaCl��Һ | H2O |
ʵ������ | �н϶����ݲ��� | ���ݼ��� |
���У���ˮ����ʵ���Ŀ����_____�����ݱ��е�ʵ�����������һ��ʵ�鷽��֤���������ӣ�C1���������������ӣ�Na+���ܹ��ӿ�þ��ˮ�ķ�Ӧ���ʣ�_____��