题目内容
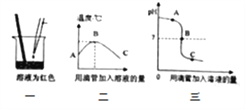
【题目】二氧化锰因在工业生产中应用广泛而备受关注,制备二氧化锰是一项有意义的工作,某研究性小组采用如下左图装置焙烧MnCO3制取MnO2。
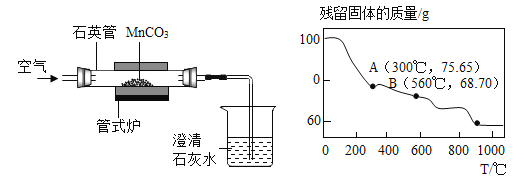
已知:MnCO3在空气中加热时依次发生下列反应:
![]()
![]()
![]()
(1)焙烧时向石英管中通入空气的目的是__________。
(2)焙烧MnCO3时,测得残留固体的质量随温度的变化如上右图所示,则焙烧MnCO3制取MnO2应该控制反应的温度为________℃。
(3)试根据化学方程式求11.5 g MnCO3通过焙烧最多制得的MnO2的质量为_________。(请列式写出计算过程)。
(4)计算11.5 g MnCO3加热到900℃时得到的固体中所含氧元素质量的方法有很多,其中结合有关数据并利用如右上图所示数据进行计算的表达式为_________(保留原始数字,不得化简)。
【答案】 提供MnCO3转化为MnO2所需要的氧气 300 8.7g 11.5 g×![]() ×
×![]()
【解析】(1)焙烧时向石英管中通入空气的目的是提供MnCO3转化为MnO2所需要的氧气。(2)300℃以内只生成二氧化锰,所以应该控制温度在300℃。(3)设11.5 g MnCO3通过焙烧最多制得的MnO2的质量为x。
![]()
2×115 2×87
11.5g x
![]() =
=![]() ,解得x=8.7g
,解得x=8.7g
(4)由图可知,MnCO3加热到900℃时得到的固体是MnO,设11.5 g MnCO3加热到900℃时得到的MnO的质量为y,根据三个化学方程式,知道MnCO3与MnO之间的关系是:
MnCO3--------MnO
115 71
11.5 g y
![]() =
=![]() ,解得y=11.5 g×
,解得y=11.5 g×![]() ,其中所含氧元素质量为:11.5 g×
,其中所含氧元素质量为:11.5 g×![]() ×
×![]()

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目