题目内容
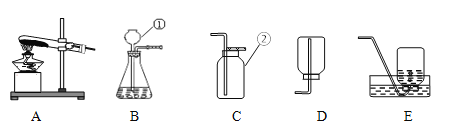
【题目】如图是实验室制取气体常用的仪器或装置。

(1)图中仪器B的名称是___;
(2)若用氯酸钾制取氧气,除上述仪器外还需要增加一种仪器,其名称是___,该反应的化学方程式为_____________;若选用C装置收集氧气,开始收集的适宜时刻是___;
(3)若用G装置制取二氧化碳气体的优点是____________________________
【答案】 长颈漏斗 酒精灯; 2KClO3![]() 2KCl + 3O2 ↑; 连续均匀气泡冒出时 控制反应开始与结束
2KCl + 3O2 ↑; 连续均匀气泡冒出时 控制反应开始与结束
【解析】本题考查了实验室制取气体的反应原理、装置选取,实验的注意事项等。发生装置依据反应物的状态和反应条件选择。
(1)仪器B的名称是长颈漏斗;
(2)若用氯酸钾制取氧气,还需要酒精灯加热,所以需要增加一种仪器,其名称是酒精灯;氯酸钾在二氧化锰作催化剂、加热的条件下生成氯化钾和氧气,该反应的化学方程式为:2KClO3![]() 2KCl + 3O2 ↑;若选用C装置收集氧气,开始收集的适宜时刻是气泡均匀、连续冒出时,因为开始出来的气体中含有试管内的空气;
2KCl + 3O2 ↑;若选用C装置收集氧气,开始收集的适宜时刻是气泡均匀、连续冒出时,因为开始出来的气体中含有试管内的空气;
(3)关闭止水夹,小塑料瓶内压强增大,液体被压入半截塑料瓶中,固液分离,反应停止;打开止水夹后,固液接触,反应进行;使用该套装置制取气体的优点是可以随时控制反应的发生和停止。

【题目】某化学实验小组要测定一种纯碱样品中碳酸钠的含量,并用一定溶质质量分数的稀硫酸进行实验,记录实验数据如下(样品中杂质不含钠元素、不溶于水也不与硫酸反应)
第一次 | 第二次 | 第三次 | |
加入的稀硫酸的质量(g) | 100 | 100 | 100 |
加入的样品的质量(g) | 20 | 40 | 42 |
生成气体的质量(g) | 2.2 | a | 4.4 |
(1)上表中a=_________;
(2)根据已知条件列出求解第三次参加反应的纯碱的质量(x)的比例式__________;
(3)将第二次实验所得的溶液蒸发掉6.2g水,所得不饱和溶液中溶质的质量分数为___________;
(4)若配制实验中所用稀硫酸200g,需要用溶质质量分数为98%的浓硫酸的质量为________;
(5)这种纯碱样品中碳酸钠的质量分数为______________。