题目内容
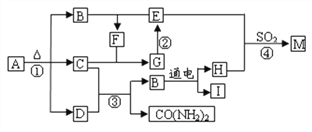
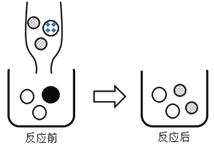
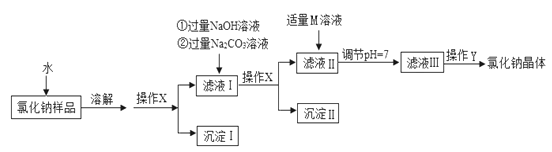
【题目】氯化钠是日常生活中的必需品。某氯化钠样品中除含氯化钠外,还含有少量的CaCl2、MgCl2以及不溶性杂质。以下是提纯该样品的流程图。
请回答:
(1)操作X中,需要用到的玻璃仪器有烧杯、玻璃棒、__________。
(2)加入NaOH溶液可除去的阳离子是_______________(填离子符号),该反应的化学方程式为________________。
(3)加入Na2CO3溶液的目的是_____,得到的滤液Ⅱ中的溶质所含阴离子有__________。
(4)M的化学式为________________。
(5)操作Y中要用到玻璃棒,其作用是_____________________。
【答案】 漏斗 Mg2+ 2NaOH+MgCl2 == Mg(OH)2↓ + 2NaCl 除去滤液中的CaCl2 (或Ca2+) Cl- 、 OH- 、CO32- HCl 搅拌,防止局部过热,液滴飞溅
【解析】某氯化钠样品中除含氯化钠外,还含有少量的CaCl2、MgCl2以及不溶性杂质。(1)操作X属于过滤,过滤中需要用到的玻璃仪器有烧杯、玻璃棒、漏斗。(2)加入NaOH溶液可除去的阳离子是Mg2+,镁离子与氢氧根离子结合,生成氢氧化镁白色沉淀,该反应的化学方程式为2NaOH+MgCl2 == Mg(OH)2↓ + 2NaCl。(3)加入Na2CO3溶液的目的是除去滤液中的CaCl2 (或Ca2+) ,碳酸根离子与钙离子结合生成碳酸钙白色沉淀。得到的滤液Ⅱ中的溶质所含阴离子有. Cl- 、 OH- 、CO32-,氢氧化钠和碳酸钠溶液均过量,氢氧化钠与 MgCl2反应生成氢氧化镁白色沉淀和氯化钠,碳酸钠溶液与CaCl2反应生成碳酸钙白色沉淀和氯化钠。(4)M是盐酸,其化学式为HCl。(5)操作Y中要用到玻璃棒,其作用是搅拌,防止局部过热,液滴飞溅。
点睛∶过滤中需要用到的玻璃仪器有烧杯、玻璃棒、漏斗。碳酸根离子与钙离子结合生成碳酸钙白色沉淀。镁离子与氢氧根离子结合,生成氢氧化镁白色沉淀。

 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案