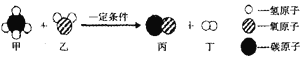
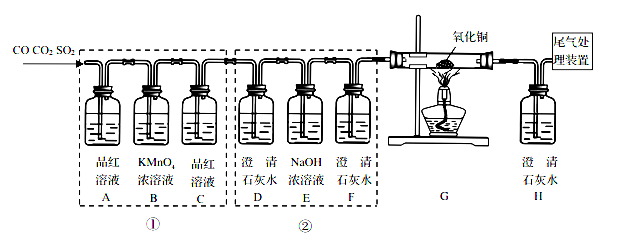
题目内容
【题目】下列化学方程式与实际相符,且书写正确的是
A. 铁丝在氧气中燃烧:4Fe+3O2=2Fe2O3
B. 洗去试管壁上附着的铜: Cu+H2SO4 =CuSO4 +H2↑
C. 用氢氧化钠溶液吸收二氧化硫:2NaOH+SO2=Na2SO4 +H2O
D. 用氢氧化镁中和过多胃酸:Mg(OH)2+2HCl=MgCl2+2H2O
【答案】D
【解析】A. 铁丝在氧气中燃烧:3Fe+2O2![]() Fe3O4,错误; B. 铜不与稀硫酸反应,不能用稀硫酸洗去试管壁上附着的铜,错误;C. 用氢氧化钠溶液吸收二氧化硫:2NaOH+SO2=Na2SO3 +H2O,错误;D. 用氢氧化镁中和过多胃酸:Mg(OH)2+2HCl=MgCl2+2H2O,正确。故选D。
Fe3O4,错误; B. 铜不与稀硫酸反应,不能用稀硫酸洗去试管壁上附着的铜,错误;C. 用氢氧化钠溶液吸收二氧化硫:2NaOH+SO2=Na2SO3 +H2O,错误;D. 用氢氧化镁中和过多胃酸:Mg(OH)2+2HCl=MgCl2+2H2O,正确。故选D。

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案【题目】实验室有一瓶长期放置的氢氧化钠固体,某兴趣小组同学欲对该固体变质情况进行探究。
Ⅰ.固体的成分分析
【提出问题】该瓶氢氧化钠固体是否变质,变质情况如何?
【查阅资料】①氢氧化钠在空气中容易变质但不会转化为NaHCO3;
②CaCl2溶液的pH=7。
③碱石灰是CaO和NaOH的混合物
【提出猜想】猜想Ⅰ:固体未变质,只有NaOH
猜想Ⅱ:固体全部变质,只有Na2CO3
猜想Ⅲ:固体部分变质,是NaOH 和Na2CO3 的混合物
【原因分析】氢氧化钠在空气中变质的原因是_______________(用化学方程式表示)。
【进行实验】小聪同学取少量样品于烧杯中,用足量水溶解,再向溶液中滴入几滴酚酞试液,溶液变红,由此他得出猜想Ⅰ正确,但其他同学很快予以否定,否定的理由是________________,为了进一步得出结论,组内其他三位同学分别取小聪实验后的溶液于试管中,进行如下表所示实验。
同学 | 小钱 | 小徐 | 小陆 |
实验操作 | 加入适量氢氧化钙溶液 | 加入过量氯化钙溶液 | 逐滴加入稀盐酸至过量 |
【实验结论】小钱、小徐的实验中都观察到有白色沉淀生成且溶液仍是红色,于是他们都得出猜想Ⅲ正确。
【反思评价】(一)老师指出,仅凭小钱的实验操作和现象无法确定猜想Ⅲ正确,理由是__________________。
(二)根据小徐的结论推测小陆实验现象是_________________________________。
Ⅱ 固体中各成分含量
【提出问题】如何测定变质的氢氧化钠固体中碳酸钠的质量分数?
【进行实验】化学小组同学设计了如下实验装置。
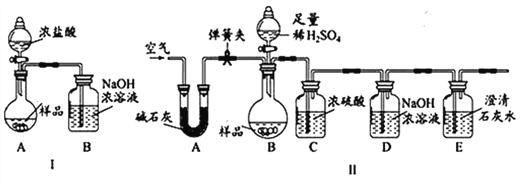
(一)小陆同学认为通过测定装置 I中反应前后B的质量差,再通过相应计算,就可测定Na2CO3的纯度,小组内同学通过讨论认为不可以,其理由可能是 _______________________;
(二)小钱同学在大家讨论的基础上,设计了装置II。请分析:装置II中A的作用_____________;若无装置C,对测定结果造成的影响是_____________(填“偏大”、“偏小”或“无影响”);E装置的作用是_______________________________。
【实验结论】称取10g样品于圆底烧瓶中,实验结束后,测得装置D增重2.2g,请你计算出样品中Na2CO3质量分数为____________。(写出计算过程)
【反思评价】(一)实验室中的氢氧化钠应密封保存,除了因为空气中有二氧化碳,还因为___________。
(二)若将上述5g氢氧化钠固体全部溶解在45g水中,得到的溶液中氢氧化钠质量分数______10%(填“大于”、“小于”或“等于”)。