题目内容
【题目】按要求填空
(1)用化学用语填空:
两个氮原子_____; 两个硫酸根根离子_____;地壳中含量最多的元素_____;氧化铝中铝元素的化合价_____。
(2)下列化学符号中数字"2”所表示的意义,将其序号填在相应的横线上:
①Mg2+ ②H2O ③2CO ④![]()
I表示分子数的是_____; Ⅱ表示一个离子所带电荷的是_____;Ⅲ表示元素化合价的是_____; IV表示一个分子中所含原子个数是_____。
(3)人类对微观世界的认识永无止境,认识和了解构成物质的奥秘是学好化学的基础.
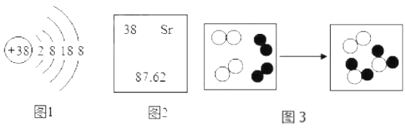
①图1为某元素离子的结构示意图,该元素属于_____ (填 “金属”或“非金属”),该元素在周期表中处于第_____周期。
②根据图1和图2写出图1表示的粒子符号_____。
③图3是某化学反应过程的微观示意图(“●”、"![]() " 分别表示不同种元素的原子,参加反应的
" 分别表示不同种元素的原子,参加反应的![]() 与
与![]() 的个数比是_____; 该反应的基本类型是_____。
的个数比是_____; 该反应的基本类型是_____。
【答案】2N 2SO42- O ![]() ③ ① ④ ② 金属 五 Sr2+ 1:2 化合反应
③ ① ④ ② 金属 五 Sr2+ 1:2 化合反应
【解析】
化合反应是两种或两种以上物质生成一种物质的反应。
(1)两个氮原子表示为2N; 两个硫酸根根离子为2SO42-;地壳中含量最多的元素是氧元素,元素符号为O;氧化铝中铝元素的化合价为+3价,表示为![]() 。
。
(2)①Mg2+表示1个镁离子带2个单位的正电荷;
②H2O表示1个水分子或1个水分子含有2个氢原子和1个氧原子;
③2CO表示2个一氧化碳分子;
④![]() 表示镁元素的化合价为+2价。
表示镁元素的化合价为+2价。
I表示分子数的是③; Ⅱ表示一个离子所带电荷的是①;Ⅲ表示元素化合价的是④; IV表示一个分子中所含原子个数是②。
(3)①图1的质子数为38,锶元素离子的结构示意图,元素属于金属,该元素原子的核外电子层数为5,在周期表中处于第五周期。
②图1中最外层电子数为![]() ,容易失去最外层2个电子,形成锶离子,故图1表示的粒子符号为Sr2+。
,容易失去最外层2个电子,形成锶离子,故图1表示的粒子符号为Sr2+。
③由化学反应过程的微观示意图可知,1个![]() 未参加反应,故参加反应的
未参加反应,故参加反应的![]() 与
与![]() 的个数比是1:2; 反应是两种单质生成一种化合物,故该反应的基本类型是化合反应。
的个数比是1:2; 反应是两种单质生成一种化合物,故该反应的基本类型是化合反应。

【题目】高锰酸钾在生产、生活中有广泛应用。实验小组对高锰酸钾的腐蚀性进行研究。
(进行实验)
实验1:将新鲜鸡皮在不同浓度的KMnO4溶液中浸泡相同时间,现象如下表。
KMnO4溶液浓度 | 0.002% | 0.01% | 0.1% | 1% |
鸡皮的变化 | 无明显变化 | 边缘部分变为棕黄色 | 全部变为棕色 | 全部变为黑色 |
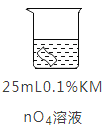
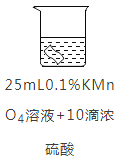
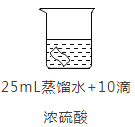
实验2:将铜片分别浸泡在4种溶液中进行实验,所得数据如下表。
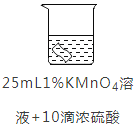
编号 | ① | ② | ③ | ④ | |
实验 |
|
|
|
| |
铜片质量/g | 实验前 | 0.54 | 0.54 | 0.54 | 0.54 |
18小时后 | 0. 54 | 0. 52 | 0. 54 | 0. 43 | |
(解释与结论)
(
(2)实验2中,设计实验③的目的是__________。
(3)实验2中,通过对比②和④,得出的结论是__________。
(4)实验2中,欲得出“KMnO4和硫酸共同作用对铜才有腐蚀性”的结论,需要对比_________ (填编号)。
(5)实验2中,铜片被腐蚀的反应如下,补全该反应的化学方程式。5Cu + 2KMnO4+ 8H2SO4=5CuSO4 + 2MnSO4 + K2SO4+_________
【题目】为了测定某黄铜(铜锌合金)样品的组成,某化学兴趣小组的同学进行了以下实验:取四份相同质量的样品分别放入等质量的烧杯中,然后分别加入稀硫酸,充分反映后用天平称量,几次试验数据如下
试验次序 | 第1次 | 第2次 | 第3次 | 第4次 |
所取样品的质量/g | 50.0 | 50.0 | 50.0 | 50.0 |
加入稀硫酸的质量/g | 20.0 | 40.0 | 60.0 | 80.0 |
生成气体的质量/g | 0.2 | 0.4 | 0.5 | 0.5 |
请回答下列问题并计算:
(1)50g样品与________g稀硫酸恰好完全反应;
(2)计算样品中锌的质量分数_______(写出具体计算过程)
(3)请在图中画出加入稀硫酸的质量与生成气体的质量的变化关系_______。