题目内容
【题目】水是生命之源,也是人类最宝贵的资源。
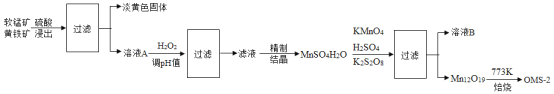
(1)下图是水电解过程的示意图,微粒运动变化的先后顺序是______
由质量守恒定律可知,以下在化学变化中不会发生改变的是______
A 原子种类 B 分子种类 C 原子个数 D 元素种类 E 物质种类
由此可知,化学变化的本质是______。
(2)实验过程中,正极产生的气体是______(填化学式),正负极气体的质量比为______。写出该反应的化学方程式______。
(3)某些地方的水质较硬,烧水时,水壶很容易结水垢,生活中可用______清洗水壶中的水垢。
【答案】①②③④ ACD 分子分成原子,原子再重新组合成新的分子 O2 8:1 2H2O![]() 2H2↑+O2↑ 食醋
2H2↑+O2↑ 食醋
【解析】
(1)水电解的过程可用下列图示表示,微粒运动变化的先后顺序是:水分子分解成氢原子和氧原子,氢原子和氢原子结合成氢分子,氧原子和氧原子结合成氧分子。顺序是:①②③④;由质量守恒定律可知,在化学反应前后,原子的种类、数目和质量不变,元素的种类也不变,分子的种类一定改变;物质的种类一定改变;由此可知,化学变化的本质是分子分成原子,原子再重新组合成新的分子;故填:①②③④;ACD;分子分成原子,原子再重新组合成新的分子;
(2)电解水时,正极产生的气体是氧气,负极产生的是氢气,氧气与氢气的质量比为32:(2×2)=8:1;水在通电的条件下分解为氢气和氧气;故填:O2;8:1;
2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
(3)水垢能与醋酸反应,所以可用食醋来除去水壶中的水垢;故填:食醋。

 优学名师名题系列答案
优学名师名题系列答案【题目】我国著名化学家侯德榜先生发明了“侯氏制碱法”,其原理中重要的一步是向饱和食盐水中先后通入足量NH3和CO2制备NaHCO3,化学方程式:NaCl+ NH3+CO2+H2O= NaHCO3↓+NH4Cl
某兴趣小组在实验室模拟该过程,请结合具体的步骤回答下列问题:
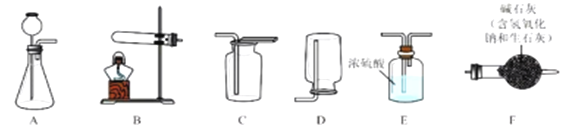
I.气体制备
(1)二氧化碳气体制备
实验室常采用石灰石与稀盐酸反应制备CO2,其化学方程式为_____________。应选择的气体收集装置为______(选填装置对应的字母)。
(2)氨气制备
实验室常用硫酸吸收氨气,防止污染空气,实验室制备NH3的反应原理为:Ca(OH)2(固)+2NH4Cl(固) ![]() CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
CaCl2+2H2O+2NH3↑。现要制备并干燥NH3,所选装置的正确连接顺序为_____→______(选择装置对应的字母)。实验室制备O2也可用上述制备NH3的发生装置,写出用该发生装置制备O2的化学方程式__________。
II.NaHCO3制备
物质 | NaHCO3 | NH4Cl |
溶解度/g(20℃) | 9.6 | 37.2 |
(3)根据表格中的溶解度数据,解释20℃产物中NaHCO3能够先从溶液中结晶析出的原因________。
(4)该过程中另一产物NH4Cl在农业生产中常被用作______________。