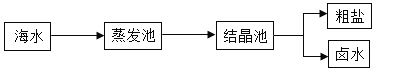
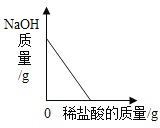
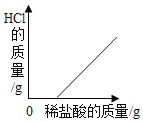
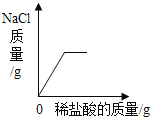
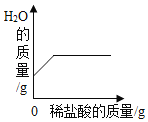
题目内容
【题目】加热![]() 制备
制备![]() 并用排水法收集氧气的实验完毕后,应先将导管从水槽中移出,后熄灭酒精灯。很据上述示例,写出下列实验操作中的“先”与“后”关系:
并用排水法收集氧气的实验完毕后,应先将导管从水槽中移出,后熄灭酒精灯。很据上述示例,写出下列实验操作中的“先”与“后”关系:
(1)稀释浓硫酸时:应先在烧杯中_____,后_____。
(2)连接好气体发生装置后,检查装置气密性的操作:应该先_____,后_____。
【答案】放入水 缓慢加入浓硫酸,并用玻璃棒不断的搅拌 将导气管放入水中 用手后捂住
【解析】
(1)浓硫酸的密度大于水,溶于水时放出大量的热。稀释浓硫酸时:应先在烧杯中放入水,后缓慢加入浓硫酸,并用玻璃棒不断的搅拌;
(2)检查装置气密性时,应先形成密闭体系,气体受热膨胀。连接好气体发生装置后,检查装置气密性的操作:应该先将导气管放入水中,后用手后捂住,若在水中观察到有气泡生成,则装置的气密性良好。

【题目】化学兴趣小组对实验室药品柜中的一瓶盐酸的性质和质量分数进行探究,请你参与:
知识回顾:在打开浓盐酸时常会看到瓶口有_____的现象,浓盐酸具有挥发性,导致这瓶盐酸溶液的质量分数变_____(填“大”、“小”)。
(实验探究Ⅰ)探究这瓶盐酸的化学性质
(1)请从下列试剂中选择试剂进行检验盐酸的化学性质,填写实验报告:
供选择试剂:紫色石蕊试液、酚酞试液、锌粒、铜片、氧化铜、氢氧化钠溶液、硫酸铜溶液
实验步骤 | 预计实验现象 |
取少量溶液于试管中,滴加_____ | 溶液变红色 |
另取少量溶液于试管中加入_____ | 有气泡产生 |
(实验探究Ⅱ)测定这瓶盐酸溶液中溶质的质量分数
(查阅资料)HCl+AgNO3═AgCl↓+2HNO3
(设计实验)小组同学设计了如下两套方案,请协助他们完成实验方案的设计。
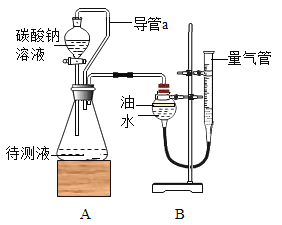
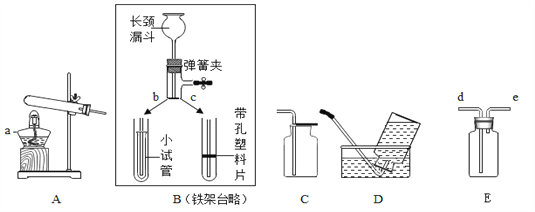
方案Ⅰ往盐酸中加入碳酸钠溶液反应产生气体,通过产生气体的量进行计算。取20mL的盐酸于锥形瓶中,加入足量的碳酸钠溶液并用如图所示装置进行实验:(假设该实验温度下,盐酸的密度均为1g/mL,二氧化碳的密度为2g/L)
(2)实验装置A中发生反应的化学方程式为_____。
(3)实验过程中,当观察到_____,说明加入的碳酸钠已经足量了。
(4)实验前量气管中水的体积为2.0mL,实验结束后量气管中水的体积为222.0mL,则生成二氧化碳的体积是_____mL。
(5)同学经过交流讨论后认为还必须考虑装置A和装置B内原有的气体.你认为装置A和装置B内原有的气体对实验的结果_____(填“有”或“没有”)影响。方案Ⅱ盐酸中加入硝酸银溶液反应产生沉淀,通过产生沉淀的量进行计算。于是同学们另取一定量的盐酸,按如下流程进行探究:
![]()
(6)产生的白色沉淀物质是_____。
【题目】熟石灰在部分温度下的溶解度如下表所示。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
溶解度/g | 0.18 | 0.17 | 0.16 | 0.15 | 0.14 | 0.13 | 0.12 |
①20℃时,0.56 g氧化钙放入到盛有100 g水的烧杯中。恢复到20℃时,所得溶液中水的质量_____(填“增大”、“减小”或“不变”),溶液中溶质的质量分数是 _____(写计算式)。
②采用一种操作方法,将上述烧杯中剩余固体全部溶解,变为不饱和溶液。下列说法正确的是 ____。
A 溶液的质量可能不变 B 溶液中溶质的质量分数一定减小
C 溶液中溶质的质量一定增大 D 可以升温使之变成不饱和溶液