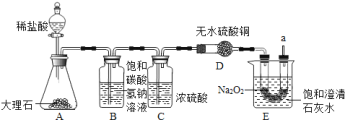
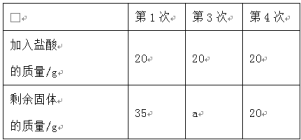
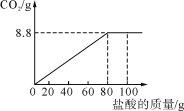
题目内容
【题目】“生活即学习”、“社会即教材”,化学在衣食住行、环境能源、材料科学等方面越来越大地体现自己的价值.
(1)低碳经济是一种以低能耗和高效能等为主要特征,请问:
①近年来大气中二氧化碳含量不断上升的主要原因是,自然界中消耗二氧化碳的主要途径是________;
②下列做法不符合“低碳经济”理念的是________(填序号).
A.改造或淘汰高能耗、高污染产业
B.大力发展火力发电
C.研制和开发新能源替代传统能源
D.优化建筑设计,增强室内自然采光,减少照明用电
(2)煤燃烧过程中某些反应的微观示意图如下:
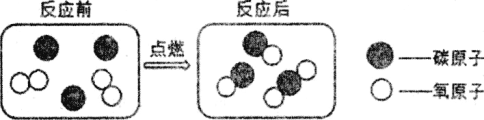
该反应中生成物的化学式为________;为了能使煤充分燃烧提高燃料利用率,在反应物中应增加的微粒是________(填序号)。
A.![]() B.
B.![]()
C. D.
D.![]()
(3)图1为某品牌矿物质水的标签.用离子符号表示其中的一种金属阳离子________;一种阴离子________.
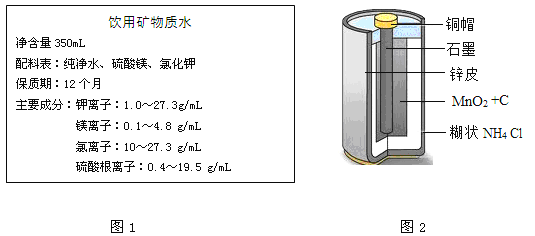
(4)图2为普通干电池的构造图,小明从废旧干电池中回收有关物质并进行探究.
①干电池用作照明时化学能转化为________.
②石墨不但具有优良的导电性,而且________,它还可以做高温电炉的电极。
③锌皮回收可用于实验室制取氢气,其反应的基本类型是________.
④铜帽回收清洗后放入硝酸银溶液中,观察到的现象是________.
(5)下图是画家用碳墨绘制的我国明朝诗人于谦《石灰吟》的国画,诗中写道:“千锤万凿出深山,烈火焚烧若等闲,粉身碎骨浑不怕,要留清白在人间”。试回答:

①该字画能够保存多年而不变色,原因是________。
②诗句中“千锤万凿出深山”所体现物质的变化属于________变化;“烈火焚烧若等闲”所体现的化学反应是石灰石受热分解,会产生CO2,固体的CO2俗称________,写出它在生活、生产中的一种用途:________。
【答案】光合作用BCOCO2BK+或Mg2+;Cl-或![]() 电能熔点高,耐高温置换反应铜的表面有银白色固体析出.碳在常温下化学性质稳定②物理;干冰;人工降雨或保存易变质食品
电能熔点高,耐高温置换反应铜的表面有银白色固体析出.碳在常温下化学性质稳定②物理;干冰;人工降雨或保存易变质食品
【解析】
(1)①化石燃料的燃烧会产生大量的二氧化碳;植物的光合作用的原料是二氧化碳和水,生成物是氧气和有机物,所以自然界中消耗二氧化碳的主要途径是植物的光合作用;②A、改造或淘汰高能耗、高污染产业,有利于减少二氧化碳的产生,符合低碳理念;B、大力发展火力发电,会增加二氧化碳的排放,高耗能,不符合低碳理念;C、研制和开发新能源替代传统能源,如发展光能,地热能等,符合低碳理念;D、优化建筑设计,增强室内自然采光,减少照明用电,有利于节能减排,符合低碳理念;
(2)由煤燃烧过程中某些反应的微观示意图可知,该反应中生成物为二氧化碳和一氧化碳,化学式分别为:CO2、CO,为了能使煤充分燃烧提高燃料利用率,在反应物中应增加氧气的量,可增加的微粒是氧分子;
(3)由某品牌矿泉水的标签,钾离子、镁离子属于金属阳离子,其离子符号分别为K+、Mg2+;氯离子、硫酸根离子属于阴离子,其离子符号分别是Cl-、SO42-;
(4)①干电池的工作原理是电池内部发生化学变化并把化学能转化为电能;
②干电池中石墨表现出优良的导电性能,并且熔点高,耐高温,可以做高温电炉的电极;
③锌和稀硫酸反应可以制取氢气同时生成硫酸锌,化学方程式为:Zn+H2SO4═ZnSO4+H2↑,属于置换反应;
④铜能与硝酸银反应生成硝酸铜和银,现象为:铜的表面有银白色固体析出;
(5)①该字画能够保存多年而不变色,因为墨的主要成分碳在常温下碳的化学性质不活泼,很难与其它物质发生反应,保存的时间较长;
②)“千锤万凿出深山”,含义是开采石灰石,没有其它物质生成,属于物理变化;固体的CO2俗称干冰;升华时吸收大量的热,可用作制冷剂、用于人工降雨等。

【题目】石灰石是生产玻璃、氯化钙等多种化工产品的原料。某研究性学习小组为了测定当地矿山石灰石中碳酸钙的质量分数,取来了矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:
实 验 | 1 | 2 | 3 | 4 |
加入样品质量/g | 5 | 10 | 15 | 20 |
生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
(1)第几次反应中矿石有剩余?_________;
(2)表中m值是________;
(3)试计算这种石灰石中碳酸钙的质量分数为_________。
【题目】为了测定某黄铜样品中锌的质量分数(不考虑黄铜中的其他杂质),现将30mL稀盐酸分三次加入到10g黄铜样品粉末中,每次充分反应后,测定生成氢气质量的实验数据如表所示,试求:
第一次 | 第二次 | 第三次 | |
加入稀盐酸的体积(mL) | 10 | 10 | 10 |
生成氢气的质量(g) | 0.08 | m | 0.04 |
(1)m=________
(2)此黄铜样品中锌的质量分数是多少______?