题目内容
【题目】甲、乙、丙三种固体物质的溶解度曲线如下图所示。据图回答问题:
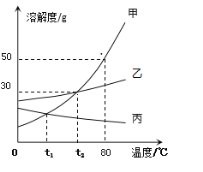
(1)80℃时,甲物质的溶解度是__________。
(2)欲将t1℃甲物质的不饱和溶液变为该温度下的饱和溶液,可采取的方法:_____(任填一种)。
(3)t2℃时,把甲、乙、丙三种物质的饱和溶液降温到t1℃,溶质质量分数不变的是______。
(4)若要让乙物质从它的饱和溶液中全部结晶析出,应采取的方法是__________。
(5)在80℃时,将150克甲物质的饱和溶液稀释成质量分数为20%的溶液需加水____ 克。
【答案】50g 增加甲物质 丙 蒸发结晶 100
【解析】
⑴根据溶解度曲线,80℃时,甲物质的溶解度是:50g;
⑵不饱和溶液变为饱和溶液的方法在只发生一个变量变化时有:加溶质;蒸发溶剂;改变温度。根据题意要求温度不变,故欲将t1℃甲物质的不饱和溶液变为该温度下的饱和溶液,可采取的方法:增加甲物质或恒温蒸发溶剂;
⑶t2℃时,把甲、乙、丙三种物质的饱和溶液降温到t1℃,甲和乙溶解度都变小,溶液中有溶质析出,而溶剂量不变,溶质质量分数减小,但丙温度下降,溶解度增大,溶液变为不饱和溶液,溶质、溶剂量 均不变,故溶质质量分数不变的是:丙;
⑷因为乙的溶解度受温度影响不大,所以若要让乙物质从它的饱和溶液中全部结晶析出,应采取的方法是:蒸发结晶;
⑸因为80℃时,甲物质的溶解度是50g,所以80℃时,将150克甲物质的饱和溶液中溶质甲的质量为50g,溶剂水的质量为100g。根据稀释前后溶质的质量不变,稀释后20%的溶液的质量=![]() =250g,则需要加水的质量=250g-150g=100g。
=250g,则需要加水的质量=250g-150g=100g。

【题目】溶解是生活中常见的现象,不同物质在水中的溶解能力不同。下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水)。
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
(1)上表中的两种物质在40℃时,_______(填化学式)的溶解度较大。
(2)请写出一种将KNO3的不饱和溶液转化为饱和溶液的方法____________________。
(3)20℃时,将20gNaCl放入50g水中,所得溶液的质量是______g。
(4)从NaCl溶液中得到NaCl晶体的方法是________。
(5)请用表格中的数据计算20℃时,NaCl饱和溶液的质量分数_________。
【题目】如图所示,某兴趣小组在进行酸碱中和反应的实验探究时,向烧杯中氢氧化钠溶液中滴加稀盐酸一会儿后,发现忘记滴加指示剂,甲同学从烧杯中取少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞溶液,振荡,观察到酚酞溶液不变色。
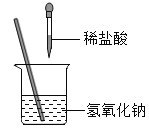
请写出该中和反应方程式:___________________________________________________。
(1)猜想与假设:
猜想一:甲同学:“两种物质已恰好完全中和,溶液呈中性”;
猜想二:乙同学:“反应后氢氧化钠过量,溶液呈碱性”;
猜想三:丙同学:__________________________________________________________。
甲、丙两位同学经过讨论后觉得乙同学的猜想不正确,两位同学的理由是:_______________________。
(2)设计并进行实验:
①为了验证自己的猜想,甲同学设计了以下实验方案:
实验步骤 | 实验现象 | 实验结论 |
用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比。 | pH________(填“>”“=”或“<”)7 | 猜想一不成立 |
②请你设计另一个实验(与甲同学方案不同)方案,验证丙同学的猜想,并填写下表:
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |
(3)拓展探究:你还能设计不同的实验方案来验证丙同学的猜想吗?
实验步骤 | 实验现象 | 实验结论 |
__________ | __________ | __________ |
【题目】下列分离或提纯物质的方法中,所依据的原理正确的是![]()
![]()
选项 | 混合物的分离或提纯 | 分离原理 |
A | 分离液态空气制取氧气 | 利用氮气和氧气的熔点不同 |
B | 将石油分馏得到石油产品 | 石油中各成分的密度不同 |
C | 分离硝酸钾和氯化钠组成的混合物 | 硝酸钾和氯化钠分解温度不同 |
D | 除去粗盐中的泥沙 | 氯化钠和泥沙的溶解性不同 |
A. A B. B C. C D. D