题目内容
【题目】某无色溶液M中可能含有硫酸钠、氯化钠、碳酸钠、氢氧化钠、氢氧化钙中的一种或几种,为确定其成分,某兴趣小组同学设计实验并进行探究。
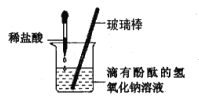
探究活动一:小组同学进行了如下图所示实验
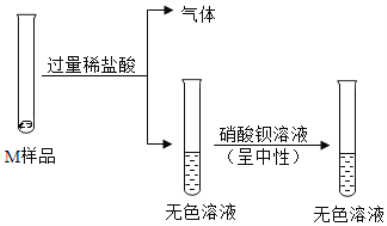
(1)反应生成气体的化学方程式是____________________________;
(2)M 中一定没有________________(填名称或化学式均可,下同);
探究活动二:为进一步确定M的成分,进行如下实验:
Ⅰ.重新取M样品,滴加酚酞;
Ⅱ.向Ⅰ所得溶液中滴加过量的试剂X,静置;
Ⅲ.向Ⅱ所得混合物中滴加过量的稀硝酸;
Ⅳ.向Ⅲ所得的溶液中滴加试剂Y,产生白色沉淀,过滤,得到滤渣和滤液。
通过探究活动二,得出结论:样品中可能存在的物质确实存在。
完成填空:
(3)试剂X是_____________(选填“氯化钡”“硝酸钡”“硝酸”或“氢氧化钡”)溶液;
(4)能确定M中含有氢氧化钠的现象是_____________________________;
(5)步骤Ⅳ所得滤液中除指示剂外,还一定含有的溶质是_____________________。
【答案】Na2CO3+2HCl═2NaCl+H2O+CO2↑ 氢氧化钙、硫酸钠 硝酸钡 向Ⅰ所得溶液中滴加过量的硝酸钡溶液后,溶液仍然是红色的 硝酸钡、硝酸钠、硝酸
【解析】
探究活动一:
(1)反应生成气体,是因为稀盐酸和碳酸钠反应生成氯化钠、水和二氧化碳,反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑。
(2)M中含有碳酸钠,则一定没有氢氧化钙,这是因为氢氧化钙和碳酸钠不能共存,加入硝酸钡得到无色溶液,说明M中一定没有硫酸钠。
探究活动二:
(3)试剂X是硝酸钡溶液,加入过量的硝酸钡时,能够除去碳酸钠,以防止对检验氢氧化钠产生影响。
(4)能确定M中含有氢氧化钠的现象是向Ⅰ所得溶液中滴加过量的硝酸钡溶液后,溶液仍然是红色的,这是因为除去碳酸钠后,如果溶液仍然是红色溶液,说明溶液显碱性,进一步说明溶液中含有氢氧化钠。
(5)Ⅲ得到的是溶液,说明溶液中不含有硫酸钠,滴加的试剂Y是硝酸银溶液,产生白色沉淀,是因为硝酸银和氯化钠反应生成了白色沉淀氯化银,说明溶液中含有氯化钠,步骤Ⅳ所得滤液中除指示剂外,还一定含有的溶质是过量的硝酸钡、反应生成的硝酸钠和加入的硝酸。

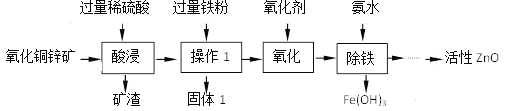
【题目】某科研小组设计利用稀H2SO4浸取某废弃的氧化铜锌矿(主要成分为CuO和ZnO,其余成分既不与酸反应,也不溶解于水)的方案。部分实验流程如下:
已知:①H2O2、KMnO4是常见的氧化剂
②各离子开始沉淀及完全沉淀时的pH如下表所示。
离子 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe3+ | 1.48 | 3.2 |
Zn2+ | 6.2 | 8.0 |
请根据上述实验流程回答下列问题:
(1)在“酸浸”步骤中,为提高浸出速率,除通入空气“搅拌”外,还可采取的措施是_________,写出硫酸溶解氧化锌的化学方程式为_________________。
(2)“操作1”所需要的主要玻璃仪器有______________________,固体1的成分是___________。
(3)“氧化”的目的是将Fe2+反应生成Fe3+,以便在后续的操作中将溶液中铁元素除去从产品纯度的角度分析,氧化剂最好选用_________________(填“H2O2"或“KMnO4”)。
(4)“除铁”过程中加入氨水的目的是通过调节溶液的pH,使Fe3+沉淀而Zn2+不沉淀,pH应控制在_______范围之间。
(5)某温度下,Fe(OH)3分解得到一种铁、氧质量比为21:8的氧化物,该氧化物的化式__________________。