题目内容
【题目】为了消除人体碘缺乏病,我国政府规定食用盐是加碘食盐,简称碘盐。所谓碘盐就是在食盐中加入一定量的碘酸钾(KIO3)。计算(计算结果精确到0.1)
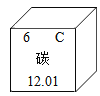
(1)KIO3的相对分子质量为__________________,
(2)碘酸钾中各元素的质量比K:I:O = __________________,
(3)42.8g碘酸钾中含碘元素的质量为______(写出计算过程)。
【答案】214 39:127:48 25.4g
【解析】
根据化学式的意义进行相关的计算,注意要结合题目要求以及使用正确的相对原子质量进行分析和解答。
解:(1)KIO3的相对分子质量为39+127+16×3=214;
(2)碘酸钾中各元素的质量比K:I:O=39:127:(16×3)=39:127:48;
(3)42.8g碘酸钾中含碘元素的质量为42.8g×![]() ×100%=25.4g。
×100%=25.4g。

 习题精选系列答案
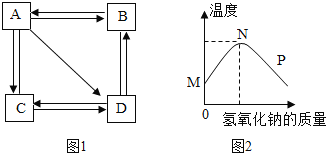
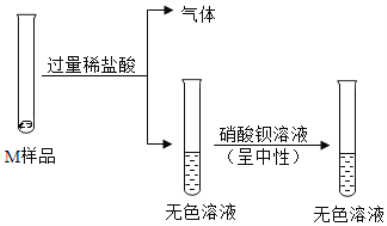
习题精选系列答案【题目】实验室常用的干燥剂“碱石灰”是CaO和NaOH固体的混合物。同学们为确认一瓶久置的“碱石灰”样品的成分,进行如下实验探究。
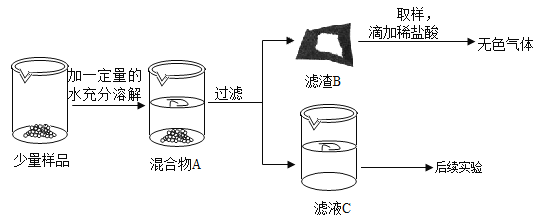
查阅资料:(1)Ca(OH)2、Na2CO3溶于水无明显的温度变化。
(2)CaCl2+Na2CO3=2NaCl+CaCO3↓。
(3)CaCl2溶液呈中性。
(1)滤渣B中一定含有_____,产生该物质的化学方程式可能是___(写出一个即可)。
(2)滤液C成分的探究。
(猜想)滤液C中的溶质可能为①NaOH;②Na2CO3;③NaOH和Ca(OH)2;④____。
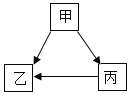
(设计方案并进行实验)甲、乙、丙同学分别设计如下方案并进行探究:
甲同学:取滤液C少许放入试管中,滴加足量的稀盐酸,产生大量无色气体,则滤液C中的溶质是Na2CO3。
乙同学:取滤液C少许放入试管中,滴加足量的无色酚酞,液体变成红色,则滤液C中的溶质一定含有NaOH。
丙同学:取滤液C少许放入试管中,滴加Ca(OH)2溶液,有白色沉淀产生。向上层清液中滴加无色酚酞,无色酚酞变成红色,则滤液C中的溶质是NaOH和Na2CO3。
(反思与评价)
丁同学认真分析上述三位同学的实验,认为他们的结论均有不足之处,并且做出了正确的判断。他认为滤液C中的溶质一定含有________,可能含有NaOH。为进一步确认滤液C中是否含NaOH,请你帮助他设计实验进行验证。
实验操作 | 实验现象 | 实验结论及解释 |
________ | ________ | 猜想④正确 |
(3)实验过程中,同学们还发现向样品中加入足量水溶解时放出大量的热。综合对滤液和滤渣成分的探究,下列对样品成分的分析正确的是__________(填序号)。
① 样品中一定含NaOH ② 样品中一定含Na2CO3
③ 样品中含NaOH、CaO中的一种或两种
【题目】实验室有一瓶保管不当的试剂(如下图),其残缺的标签中只剩下“Na”和“10%”的字样。已知它是无色液体,是初中化学常用的试剂。小欣和小芳同学很感兴趣,决定对其成分进行探究。
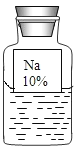
(提出猜想)
(1)这瓶试剂可能是_____溶液
①可能是NaOH溶液;②可能是Na2CO3溶液;③可能是NaCl溶液。
(2)根据受损标签的情况判断,这瓶试剂不可能是________(填字母代号)。
A.酸 B.碱 C.盐
(收集资料)
Ⅰ.初中化学常见的含钠化合物有NaCl、NaOH、Na2CO3、NaHCO3。
Ⅱ.测定室温(20 ℃)时,四种物质的溶解度的数据如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
溶解度/g | 36 | 109 | 215 | 9.6 |
(得出结论)
(3)小欣根据试剂瓶标注的溶质质量分数10%和上表中的溶解度的数据判断,这瓶试剂不可能是________(填物质名称)。
(设计实验)
(4)①小芳用胶头滴管吸取该溶液滴在pH试纸上,测得pH>7,这瓶试剂不可能是____,结论正确。
②小欣为了检验该溶液是NaOH溶液还是Na2CO3溶液,她又进行了如下实验:
操作步骤 | 实验现象 | 结论及化学方程式 |
取样于试管中,滴加氢氧化钙溶液 | _______________ | 猜想②正确,相关的化学方程式:___________________ |
(5)请你选择与小欣不同类别的试剂,来鉴别NaOH溶液和Na2CO3溶液,你选择__________溶液。