题目内容
请根据下列装置图回答问题: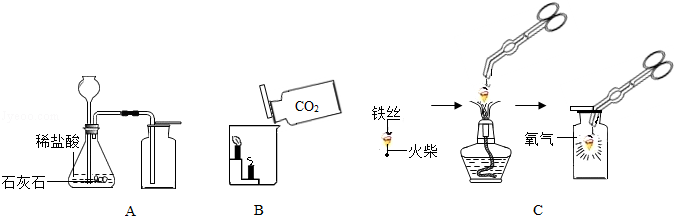
(1)A中制取气体的化学方程式为 ; A装置还可用于实验室制取另一种气体的化学方程式为 。
(2)B中,将二氧化碳气体慢慢倒入放有燃着蜡烛的烧杯中,下层蜡烛先熄灭,说明二氧化碳具有 性质,这一性质在实际生活中的应用为 。
(3)小明按C图实验时,集气瓶底部炸裂,其可能的原因是 。
(4)小明对铁丝在氧气中燃烧为什么会火星四射进行探究。他将镁和不同含碳量的铁(镁和铁直径均为0.4mm)放入氧气中燃烧,并将现象记录在下表中。
| 物质 | 镁 | 含碳0.05%的铁 | 含碳0.2%的铁 | 含碳0.6%的铁 |
| 燃烧时 的现象 | 剧烈燃烧,发出 耀眼白光,无火星 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | (未填) |
①你认为表中未填的实验现象是 。
②造成铁丝在氧气中燃烧时火星四射的主要原因是 。
(1)CaCO3+2HCl=CaCl2+CO2↑+H2O;2H2O2 2H2O+O2↑
2H2O+O2↑
(2)不可燃、不支持燃烧、密度比空气大;灭火 (3)集气瓶底未放少量水或细沙
(4)①剧烈燃烧,火星四射 ②铁丝中含有的碳引起的
解析试题分析:(1)根据装置是固液装置,且收集的气体密度比空气大分析。由A装置知,实验室可用大理石与稀盐酸反应制取二氧化碳以及双氧水在二氧化锰作催化剂的条件下制取氧气,故答案为:CaCO3+2HCl=CaCl2+CO2↑+H2O;2H2O2 2H2O+O2↑;
2H2O+O2↑;
(2)根据现象判断二氧化碳的性质。蜡烛熄灭,说明二氧化碳不可燃、不支持燃烧,下层蜡烛先熄灭说明密度比空气大;由二氧化碳的性质可知二氧化碳可用于灭火;故答案为:不可燃、不支持燃烧、密度比空气大;灭火。
(3)根据铁丝在氧气中燃烧的注意事项分析。铁丝在氧气中燃烧,如集气瓶底未放少量水或细沙会导致集气瓶炸裂,故答案为:集气瓶底未放少量水或细沙。
(4)通过对比可知铁丝含碳越高,火星越多,所以铁丝在氧气中燃烧产生火星四射现象与含碳量有关。
①由前三项对比可知铁丝含碳量越高火星越多,所以未填内容应为:剧烈燃烧,火星四射;
②由以上探究可知:铁丝在氧气中燃烧产生火星的多少与含碳量有关,所以铁丝在氧气中燃烧产生火星四射现象的原因可能是铁丝中含碳量≥0.6%.故答案为:铁丝中含有的碳引起的。
考点:考查二氧化碳的实验室制法;氧气的化学性质;二氧化碳的物理性质;二氧化碳的化学性质;书写化学方程式

下列实验方案中,设计不合理的是
| A.用带火星的木条检验氧气 |
| B.用MnO2来鉴别水和过氧化氢溶液 |
| C.用过滤的方法将浑浊的水变为澄清的水 |
| D.用燃烧木炭的方法制备纯净的二氧化碳气体 |
某实验小组的同学用氢氧化钙和盐酸进行酸碱中和的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸,实验结束后,发现忘了滴加指示剂。他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
(1)复分解反应的发生需要一定的条件。氢氧化钙和盐酸能发生复分解反应是因为
。
(2)探究烧杯中溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是Ca(OH)2和CaCl2;猜想二:可能只有CaCl2
猜想三:可能是 。
【查阅资料】 CaCl2溶液显中性。
【进行实验】
实验一:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡,若
说明猜想一不正确。
实验二:另取烧杯内的少量溶液于另一只试管中,逐滴加入碳酸钠溶液至过量,若
,说明猜想二不正确,猜想三正确。
实验三:取少量烧杯内溶液于试管中,用下列物质中的 (填序号)不能说明
猜想三正确。
| A.紫色石蕊 | B.氢氧化铜 | C.硝酸银 | D.锌 |
① 在分析化学反应后所得物质成分时,除考虑生成物外还需考虑 。
② 要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的 。
③ 实验室欲中和100g 7.3% 的盐酸,至少需要多少克熟石灰?









