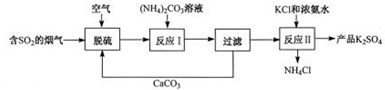
题目内容
某实验小组的同学用氢氧化钙和盐酸进行酸碱中和的实验时,向烧杯中的氢氧化钙溶液加入稀盐酸,实验结束后,发现忘了滴加指示剂。他们停止滴加稀盐酸,并对烧杯内溶液中的溶质成分进行探究。
(1)复分解反应的发生需要一定的条件。氢氧化钙和盐酸能发生复分解反应是因为
。
(2)探究烧杯中溶液中溶质的成分。
【提出问题】该烧杯内溶液中的溶质是什么?
【猜想】猜想一:可能是Ca(OH)2和CaCl2;猜想二:可能只有CaCl2
猜想三:可能是 。
【查阅资料】 CaCl2溶液显中性。
【进行实验】
实验一:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡,若
说明猜想一不正确。
实验二:另取烧杯内的少量溶液于另一只试管中,逐滴加入碳酸钠溶液至过量,若
,说明猜想二不正确,猜想三正确。
实验三:取少量烧杯内溶液于试管中,用下列物质中的 (填序号)不能说明
猜想三正确。
| A.紫色石蕊 | B.氢氧化铜 | C.硝酸银 | D.锌 |
① 在分析化学反应后所得物质成分时,除考虑生成物外还需考虑 。
② 要处理烧杯内溶液,使其溶质只含有CaCl2,应向烧杯中加入过量的 。
③ 实验室欲中和100g 7.3% 的盐酸,至少需要多少克熟石灰?
(1)有水生成
(2)CaCl2和HCl 酚酞不变红(或无明显现象) 先有气体生成,后生成白色沉淀 C 反应物是否过量 碳酸钙 (3)7.4g
解析试题分析:(1)复分解反应的发生条件:生成物中有沉淀、气体或水生成,氢氧化钙和盐酸能发生复分解反应是因为:有水生成
(2)探究反应后烧杯中溶液中溶质的成分,1、要考虑生成物,2、还要考虑反应物是否过量,故猜想三:可能是CaCl2和HCl,即反应物HC过量;
实验一:取少量烧杯内溶液于试管中,滴入几滴酚酞溶液,振荡,根据酚酞溶液遇到碱性溶液变红色,故若酚酞不变红(或无明显现象),说明不纯在Ca(OH)2,说明猜想一不正确;
实验二:要证明猜想二不正确,猜想三正确,即证明HCl的存在,取烧杯内的少量溶液于另一只试管中,逐滴加入碳酸钠溶液至过量,若先有气体生成,后生成白色沉淀,先后发生反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑,CaCl2+Na2CO3==CaCO3↓+2NaCl,则可证明
实验三:因为CaCl2和HCl都会与硝酸银反应生成白色沉淀,故选C
【反思与拓展】① 在分析化学反应后所得物质成分时,除考虑生成物外还需考虑:反应物是否过量
② 因为经过上面的探究,溶液中所含的溶质是:CaCl2和HCl,要处理烧杯内溶液,使其溶质只含有CaCl2,实际就是除去CaCl2中的杂质HCl,应向烧杯中加入过量的碳酸钙
③根据化学反应:Ca(OH)2+2HCl==CaCl2+2H2O中HCl与Ca(OH)2的质量关系,即可求出熟石灰的质量
解:设熟石灰的质量为x
Ca(OH)2+2HCl==CaCl2+2H2O
73
x 100g×7.3%
74:73=x:100g×7.3%
x=7.4g
考点:反应后溶液中溶质的判断,盐酸的化学性质,根据化学方程式计算

下列实验方案正确的是
| 选项 | 实验目的 | 所用试剂或方法 |
| A | 除去硫酸镁溶液中的硫酸 | 加入过量的Ba(OH)2溶液,过滤 |
| B | 分离氯化钠和硝酸钠固体混合物I | 加水溶解后,过滤,蒸发结晶 |
| C | 鉴别氯化铵和氯化钙 | 分别加入熟石灰,研磨,闻气味 |
| D | 鉴别羊毛织物和涤纶织物, | |
请根据下列装置图回答问题: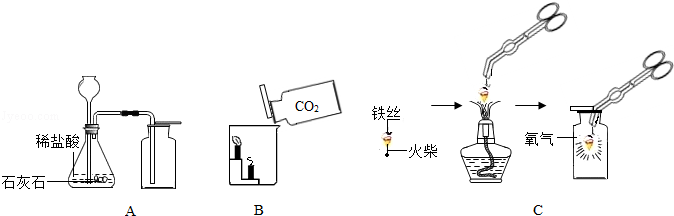
(1)A中制取气体的化学方程式为 ; A装置还可用于实验室制取另一种气体的化学方程式为 。
(2)B中,将二氧化碳气体慢慢倒入放有燃着蜡烛的烧杯中,下层蜡烛先熄灭,说明二氧化碳具有 性质,这一性质在实际生活中的应用为 。
(3)小明按C图实验时,集气瓶底部炸裂,其可能的原因是 。
(4)小明对铁丝在氧气中燃烧为什么会火星四射进行探究。他将镁和不同含碳量的铁(镁和铁直径均为0.4mm)放入氧气中燃烧,并将现象记录在下表中。
| 物质 | 镁 | 含碳0.05%的铁 | 含碳0.2%的铁 | 含碳0.6%的铁 |
| 燃烧时 的现象 | 剧烈燃烧,发出 耀眼白光,无火星 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | (未填) |
①你认为表中未填的实验现象是 。
②造成铁丝在氧气中燃烧时火星四射的主要原因是 。
为了鉴别碳酸钾溶液和氢氧化钾溶液,同学们进行了探究实验,分别取两种溶液于两支试管中,各滴入一定量的氯化钙溶液,观察到一支试管中出现白色浑浊,实验结束后,同学们将废液倒入同一个干净的烧杯中,发现废液变浑浊,同学们对废液进行了过滤,并对滤液的成分进行了探究.
【提出问题】滤液中除水外还含有那些物质?
【猜想】A.可能含有氢氧化钾、氯化钾和碳酸钾
B.可能含有氢氧化钾、氯化钾
C.可能含有氢氧化钾、氯化钾、碳酸钾和氯化钙
你认为还可能是 (写出一种猜想)
【讨论】你认为 猜想不合理(填字母),请说明理由 .
【实验设计】设计一个简单的实验,证明你的猜想正确.
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中, | | 猜想正确 |
现甲、乙两化学小组安装两套如下相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素。
(1) 下列方法能检查该装置气密性的是______。
 A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差。
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差。
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差。
C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差。
(2)MnO2催化下H2O2分解的化学方程式是 。
(3)甲小组有如下实验设计方案,完成下表。
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 探究 对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |
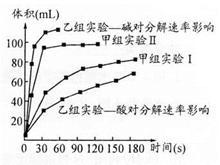
①甲组实验得出的数据可知:浓度越大,H2O2分解速率 ;
②由乙组研究的酸、碱对H2O2分解影响因素的 数据分析:相同条件下, H2O2在 (填“酸”或“碱”)性环境下放出气体速率较快;乙组提出可以用Ba02固体与硫酸溶液反应制H2O2(已知还生成另一种物质),其化学反应方程式为 ;支持这一方案的理由是 。
(7分)某地盛产石灰石,石灰石的主要成分是碳酸钙,某节课上同学们对碳酸钙高温加热一段时间剩余固体的成分进行了探究。
【提出问题】剩余固体成分是什么?
【猜想与假设】A全部是碳酸钙 B C碳酸钙和氧化钙的混合物
【设计并完成实验】请填写(1)中结论和(2)中的实验步骤及实验现象
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量固体于试管中,加适量水振荡后静置,再滴几滴无色酚酞试液。 | 溶液变红 | 剩余固体成分中一定含有 。(填化学式) |
| (2) | | 剩余固体成分中一定含有碳酸钙。 |
【讨论交流】有同学提出证明实验(1)的结论可用“取少量固体于试管中,加适量水振荡,直接通入CO2,看溶液是否变浑浊”的方案也行。你是否赞成他的观点, 原因是