题目内容
(1)某同学按下图装置对质量守恒定律进行实验探究,观察到的现象是 ,反应后天平不平衡,该反应 质量守恒定律(填“符合”或“不符合”),理由是 。
(2)由质量守恒定律可知,化学反应前后,一定不变的是
(填序号)。(3分)
①原子种类 ②原子数目 ③分子种类
④分子数目 ⑤元素种类 ⑥物质种类
(1)有气体产生;符合,逸出的气体没有称量
(2)①②⑤
解析试题分析:Na2CO3+2HCl==2NaCl+H2O+CO2↑,产生的二氧化碳会逸散到空气中导致天平不平衡,遵守质量守恒定律;由质量守恒定律可知,化学反应前后,原子种类 、原子数目、原子质量不变,元素种类、元素质量不变,物质的总质量不变。
考点:质量守恒定律

鉴别下列物质所使用的方法或试剂,正确的是( )
| A.氧化铜和木炭:看颜色 | B.铝与铝合金:比较硬度 |
| C.硬水与软水:加明矾 | D.:滴入紫色石蕊溶液 |
下列实验方案正确的是
| 选项 | 实验目的 | 所用试剂或方法 |
| A | 除去硫酸镁溶液中的硫酸 | 加入过量的Ba(OH)2溶液,过滤 |
| B | 分离氯化钠和硝酸钠固体混合物I | 加水溶解后,过滤,蒸发结晶 |
| C | 鉴别氯化铵和氯化钙 | 分别加入熟石灰,研磨,闻气味 |
| D | 鉴别羊毛织物和涤纶织物, | |
(5分)为了除去氯化钾固体样品中的少量氯化镁,一位同学设计了下图所示的除杂方案:
请回答:
(1)操作1的名称是 ,在操作中要用到的玻璃仪器中除烧杯、玻璃棒以外,还有 ;操作2的名称是 。
(2)甲溶液是 ,乙溶液是 。
| A.稀H2SO4 | B.稀HCl | C.KOH | D.NaOH |
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容。
(1)“低碳生活”倡导低能量、低消耗,主要是为了减少 (填化学式)的排放量。
(2)如图为元素周期表中的一格,下列说法不正确的是 (填标号)。
| A.碳元素属于非金属元素 |
| B.碳原子核内质子数为6 |
C.碳元素的原子结构示意图为 |
| D.碳的相对原子质量为12.01 |

①该方案中观察到纸花的颜色变化是:
I.纸花变红Ⅱ.纸花不变红Ⅲ. Ⅳ. .
②步骤I、Ⅱ两项说明了什么? 。
③该同学设计以上四组实验是为了探究什么问题?
④写出该实验中所发生反应的化学方程式 .
(4)计算要使80g氧化铜完全还原,需要碳的质量至少是多少?
请根据下列装置图回答问题: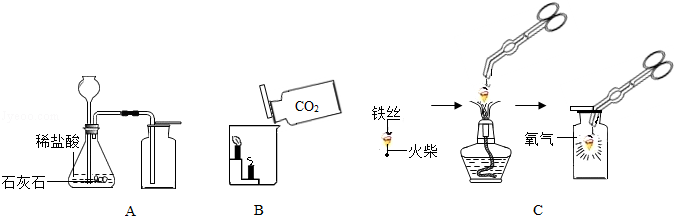
(1)A中制取气体的化学方程式为 ; A装置还可用于实验室制取另一种气体的化学方程式为 。
(2)B中,将二氧化碳气体慢慢倒入放有燃着蜡烛的烧杯中,下层蜡烛先熄灭,说明二氧化碳具有 性质,这一性质在实际生活中的应用为 。
(3)小明按C图实验时,集气瓶底部炸裂,其可能的原因是 。
(4)小明对铁丝在氧气中燃烧为什么会火星四射进行探究。他将镁和不同含碳量的铁(镁和铁直径均为0.4mm)放入氧气中燃烧,并将现象记录在下表中。
| 物质 | 镁 | 含碳0.05%的铁 | 含碳0.2%的铁 | 含碳0.6%的铁 |
| 燃烧时 的现象 | 剧烈燃烧,发出 耀眼白光,无火星 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | (未填) |
①你认为表中未填的实验现象是 。
②造成铁丝在氧气中燃烧时火星四射的主要原因是 。
现甲、乙两化学小组安装两套如下相同装置,通过测定产生相同体积气体所用时间长短来探究影响H2O2分解速率的因素。
(1) 下列方法能检查该装置气密性的是______。
 A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差。
A、将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分液漏斗颈部能形成稳定的水柱,则气密性良好,反之气密性差。
B、关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移(右移),停止加热后注射器活塞回到原来位置,则气密性良好,反之气密性差。
C、关闭分液漏斗活塞,用力将注射器活塞外移(右移),停止用力后,注射器活塞不移动,则气密性良好,反之气密性差。
(2)MnO2催化下H2O2分解的化学方程式是 。
(3)甲小组有如下实验设计方案,完成下表。
| 实验编号 | 实验目的 | 温度 | 催化剂 | 浓度 |
| 甲组实验Ⅰ | 探究 对H2O2分解速率的影响 | 25℃ | 二氧化锰 | 10mL 2%H2O2 |
| 甲组实验Ⅱ | 25℃ | 二氧化锰 | 10mL 5%H2O2 |

①甲组实验得出的数据可知:浓度越大,H2O2分解速率 ;
②由乙组研究的酸、碱对H2O2分解影响因素的 数据分析:相同条件下, H2O2在 (填“酸”或“碱”)性环境下放出气体速率较快;乙组提出可以用Ba02固体与硫酸溶液反应制H2O2(已知还生成另一种物质),其化学反应方程式为 ;支持这一方案的理由是 。
下列实验方案设计不合理的是
| A.用铅笔芯代替石墨试验导电性 | B.用燃着的木条区分二氧化碳和氮气 |
| C.用磁铁吸引来区分铁丝和铝丝 | D.用水区分氢氧化钠固体和硝酸铵固体 |

