题目内容
化学实验小组讨论测定双氧水溶液中过氧化氢的物质的量和体积。
[查阅资料]:常温下氧气密度为1.42 g/L;碱石灰干燥剂是氧化钙和固体氢氧化钠的混合物,极易吸收水蒸汽和二氧化碳。
A B C
[设计原理]:将一定质量的双氧水样品与二氧化锰混合,测定反应产生的氧气的质量,计算出其中过氧化氢的质量,从而可知双氧水溶液中过氧化氢的物质的量。
[过程方法]:
组长首先设计(如图A):向装有样品溶液的锥形瓶中投入二氧化锰,待双氧水完全反应完毕后测得产生氧气的质量是6.4g,则制取氧气为 mol,双氧水溶液含过氧化氢 mol(写出具体计算过程)
小林对组长的图A设计提出质疑,设计了如图B的方案,即在组长方案的锥形瓶上加一装有碱石灰干燥管,然后再操作,请说明小林质疑的理由是 。
若用C来制取氧气并测得氧气的体积,则氧气的体积约等于
(1)0.4mol
(2)氧气会带走水蒸气
(3)量筒中的液体体积差或流入量筒中液体的体积大小或量筒中液体的体积 或 4.5升
解析试题分析:(1)氧气的摩尔质量是32g/mol,则根据 n= 可知
可知
6.4g氧气的物质的量n= =0.2mol
=0.2mol
设H2O2的物质的量为Xmol,则根据反应的方程式可知
2H2O2  2H2O+O2↑
2H2O+O2↑
2mol 1mol
Xmol 0.2mol
即 =
=
解得X=0.4mol
(2)由于氧气会带出水蒸气,从而导致生成的氧气质量偏大。
(3)氧气不溶于水,因此氧气将试剂瓶中的水压入到量筒中,所以氧气的体积等于量筒中的液体体积差或流入量筒中液体的体积大小或量筒中液体的体积。又因为常温下氧气密度为1.42 g/L,所以氧气的体积也可以表示为V=6.4g÷1.42 g/L=4.5L。
考点:考查双氧水物质的量、氧气体积和氧气物质的量测定的实验方案设计与评价

下列实验设计能达到目的是( )
| 选项 | A | B | C | D |
| 实验设计 |  |  |  |  |
| 实验目的 | 证明二氧化碳与水反应生成碳酸 | 证明水是由氢元素和氧元素组成的 | 证明可燃物燃烧需要氧气与温度达到着火点 | 证明铁生锈是水和氧气共同作用的结果 |
碳是形成化合物种类最多的元素,含碳物质是中学化学研究的重要内容。
(1)“低碳生活”倡导低能量、低消耗,主要是为了减少 (填化学式)的排放量。
(2)如图为元素周期表中的一格,下列说法不正确的是 (填标号)。
| A.碳元素属于非金属元素 |
| B.碳原子核内质子数为6 |
C.碳元素的原子结构示意图为 |
| D.碳的相对原子质量为12.01 |

①该方案中观察到纸花的颜色变化是:
I.纸花变红Ⅱ.纸花不变红Ⅲ. Ⅳ. .
②步骤I、Ⅱ两项说明了什么? 。
③该同学设计以上四组实验是为了探究什么问题?
④写出该实验中所发生反应的化学方程式 .
(4)计算要使80g氧化铜完全还原,需要碳的质量至少是多少?
请根据下列装置图回答问题: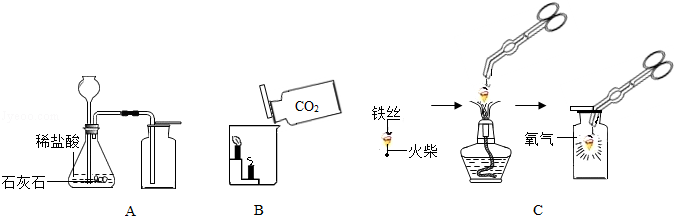
(1)A中制取气体的化学方程式为 ; A装置还可用于实验室制取另一种气体的化学方程式为 。
(2)B中,将二氧化碳气体慢慢倒入放有燃着蜡烛的烧杯中,下层蜡烛先熄灭,说明二氧化碳具有 性质,这一性质在实际生活中的应用为 。
(3)小明按C图实验时,集气瓶底部炸裂,其可能的原因是 。
(4)小明对铁丝在氧气中燃烧为什么会火星四射进行探究。他将镁和不同含碳量的铁(镁和铁直径均为0.4mm)放入氧气中燃烧,并将现象记录在下表中。
| 物质 | 镁 | 含碳0.05%的铁 | 含碳0.2%的铁 | 含碳0.6%的铁 |
| 燃烧时 的现象 | 剧烈燃烧,发出 耀眼白光,无火星 | 剧烈燃烧 极少火星 | 剧烈燃烧 少量火星 | (未填) |
①你认为表中未填的实验现象是 。
②造成铁丝在氧气中燃烧时火星四射的主要原因是 。
(5分)某校化学小组同学从家中带来淀粉、食盐、纯碱、泡打粉、去污粉和部分变质的熟石灰6种固体物质。老师从中取出任意3种并编号,让小组同学通过实验确认分别为哪种固体。
【查阅资料】
①该去污粉主要成分为碳酸钠和碳酸钙
② 该泡打粉的主要成分是碳酸氢钠和有机酸
③ 熟石灰变质的原因是因为其吸收了空气中的二氧化碳。
【实验准备】
为顺利完成任务,小组同学在老师指导下进行了如下预备实验。部分现象记录如下:
| | 实验1 取样,加足量水充分溶解 | 实验2 取样,加入适量稀盐酸 |
| 淀粉 | 白色浑浊,试管底部有不溶物 | 无明显现象 |
| 泡打粉 | 有气体产生,试管底部有白色不溶物 | 有气体产生 |
小组同学对老师提供的三种固体进行实验探究。部分现象记录如下:
| | 实验1 取样,加足量水充分溶解 | 实验2 取样,加入适量稀盐酸 | 实验3 取实验1上层清液,加入3滴酚酞溶液 |
| 固体Ⅰ | 有气体产生,试管底部有白色不溶物 | 有气体产生 | |
| 固体Ⅱ | 固体溶解,形成无色溶液 | 有气体产生 | 溶液变红 |
| 固体Ⅲ | 有白色浑浊,试管底部有白色不溶物 | 有气体产生 | 溶液变红 |
1.固体Ⅱ、Ⅲ加水形成的溶液pH 7 (填“>”、“<”或“=”);
2.分析以上实验现象得知,固体Ⅰ是 ,固体Ⅱ是 。
3.小组同学通过讨论认为固体Ⅲ不能确定的物质为 。请你设计确认该固体的实验方案 。
下列实验方案设计不合理的是
| A.用铅笔芯代替石墨试验导电性 | B.用燃着的木条区分二氧化碳和氮气 |
| C.用磁铁吸引来区分铁丝和铝丝 | D.用水区分氢氧化钠固体和硝酸铵固体 |


