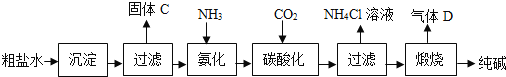
��Ŀ����
����Ŀ���ס��ҡ�������4�ֳ��л�ѧ���������ʣ����⡢̼���������е�1~3��Ԫ����ɡ� ����ͼ��ʾװ�ú��Լ���������3������ʵ�顣

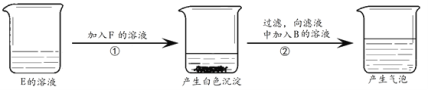
��֪����̪��Һ��Na2CO3��Һ��NaHCO3��Һ���ʺ�ɫ��
��1����K������ͷ�ι��е�ˮ���뼯��ƿ�У�����ƿ���۲쵽�ձ��еĵ��ܿ�������ð������������ƿ�ڣ��о����ȡ�
�� ��֪��Ϊ��ɫ���壬��ǿ�ҵĸ�ʴ�ԣ��׳��⣬��Ļ�ѧʽΪ_____��
�� �ձ��е��ܿ�������ð����ԭ����_____��
��2���ر�K������ƿ������������ɫ�����ҵ�ȼ����������ƿ�У�����ƿ�����۲쵽���ڱ��о���ȼ�գ������⡣ȼ�ղ��ﶡ���ӵ���ʾ��ͼΪ![]() ��������ӵ���ʾ��ͼΪ_____��
��������ӵ���ʾ��ͼΪ_____��
��3�����ҳ��ȼ����Ϩ�����ȴ�����£�����ƿ��K���۲쵽�ձ��е���Һ�ص��ܽ��뼯��ƿ��ƿ�в����������ݡ�
���ձ��е���Һ���뼯��ƿ��������ݵ�ԭ��_____���û�ѧ����ʽ���ͣ���
�� ��ַ�Ӧ����ƿ����ҺΪ��ɫ������Һ�е����ʳ���̪��NaCl�⣬��������_____��
���𰸡�NaOH NaOH�ܽ���ȣ�����ƿ������ѹǿ�����ڴ���ѹ ![]() Na2CO3+2HCl=2NaCl+CO2��+H2O��NaHCO3+HCl=NaCl+CO2��+H2O HCl
Na2CO3+2HCl=2NaCl+CO2��+H2O��NaHCO3+HCl=NaCl+CO2��+H2O HCl
��������
�ס��ҡ�������4�ֳ��л�ѧ���������ʣ����⡢̼���������е�1��3��Ԫ����ɣ���Ϊ��ɫ���壬��ǿ�ҵĸ�ʴ�ԣ��׳��⣬���Լ����������ƣ��������ƹ�������ˮ���ų���������������ɫ�����ҵ�ȼ����������ƿ�У�����ƿ�����۲쵽���ڱ��о���ȼ�գ������⣬���Ա�������ȼ�ԣ���������������̼��̼�������ڵ�ȼ�����������ɶ�����̼��̼���ƺ����ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��̼�����ƺ����ᷴӦ�����Ȼ��ơ�ˮ�Ͷ�����̼��
�������Ϸ�����֪��
��1����K������ͷ�ι��е�ˮ���뼯��ƿ�У�����ƿ���۲쵽�ձ��еĵ��ܿ�������ð������������ƿ�ڣ��о����ȣ�
����֪��Ϊ��ɫ���壬��ǿ�ҵĸ�ʴ�ԣ��׳��⣬���ԼĻ�ѧʽΪNaOH��
���ձ��е��ܿ�������ð����ԭ���ǣ�NaOH�ܽ���ȣ�����ƿ������ѹǿ�����ڴ���ѹ��
��2���ر�K������ƿ������������ɫ�����ҵ�ȼ����������ƿ�У�����ƿ�����۲쵽���ڱ��о���ȼ�գ������⣬��������̼���������������Ƕ�����̼��ȼ�ղ��ﶡ���ӵ���ʾ��ͼΪ![]() ��������ӵ���ʾ��ͼΪ��
��������ӵ���ʾ��ͼΪ��![]() ��
��
��3�����ҳ��ȼ����Ϩ�����ȴ�����£�����ƿ��K���۲쵽�ձ��е���Һ�ص��ܽ��뼯��ƿ��ƿ�в����������ݣ�
������������Һ�������̼��Ӧ������̼���ƻ�̼��̼�����ƣ�̼���ƻ�̼��̼�����ƶ��������ᷴӦ����������̼���ձ��е���Һ���뼯��ƿ��������ݵ�ԭ���ǣ�Na2CO3+2HCl=2NaCl+CO2��+H2O��NaHCO3+HCl=NaCl+CO2��+H2O��
�ڳ�ַ�Ӧ����ƿ����ҺΪ��ɫ����Һ���Լ��ԣ�����Һ�е����ʳ���̪��NaCl�⣬�������й�����HCl��

 ���źþ���Ԫ����ĩ��ϵ�д�
���źþ���Ԫ����ĩ��ϵ�д�����Ŀ��ijƷ�ƿ�Ȫˮ�ı�ǩ�ϱ����Ŀ�Ȫˮ��Ҫ�ɷ������ʾ������ݱ����ش��������⡣
ˮ����Ҫ�ɷ֣�mg/L�� | |
ƫ���ᣨH2SiO3��������28.9����42.9 ̼���������HCO3��������173����205 þ��Mg2+��������2.5����7.5 | �ȣ�Sr������0.01����0.32 �ơ�����5����45 PH������7.8��0.5 |
��1�������ӵĻ�ѧ������_____��
��2��ƫ���ᣨH2SiO3���й�Ԫ�صĻ��ϼ�Ϊ_____��
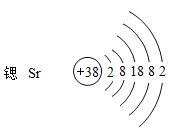
��3��������ԭ�ӽṹʾ��ͼ��д���Ȼ��ȵĻ�ѧʽ_____��