题目内容
【题目】下图装置适当组合可用于 H2、O2、CO2 等气体的制备和收集。

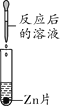
①仪器I的名称是__________,若A装置内药品为Zn和稀盐酸,反应的化学方程式为________;若B装满水,用于收集A生成的H2,则a接____________(填“b”或“c”)。
② 实验室用 A 制 O2 的原理是__________(用化学方程式表示)。
③ 装置 B 收集 CO2,验满时,燃着木条应放在_________(填“b”或 “c”)端。
④ 将实验室制得的 CO2 通入澄清石灰水,石灰水未变浑浊,作如图探究:
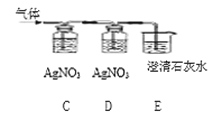
完成填空:
装置 C、E 中溶液变浑浊,D 中溶液不变浑浊,则原石灰水未变浑浊的原因是__________, 装置 D 的作用是______,E 中石灰水变浑浊的原因是______(用化学方程式 表示)。
⑤ 实验室制 CO2,若有 0.4mol 碳酸钙完全反应,求生成二氧化碳的质量。(根据化学方程式列式计算)______
【答案】 锥形瓶 Zn+2HCl=ZnCl2+H2↑ c 2H2O2![]() 2H2O+O2↑ c 制得的 CO2气体中含有 HCl 气体 检验 HCl 是否除尽 CO2+Ca(OH)2=CaCO3↓+H2O 17.6 g
2H2O+O2↑ c 制得的 CO2气体中含有 HCl 气体 检验 HCl 是否除尽 CO2+Ca(OH)2=CaCO3↓+H2O 17.6 g
【解析】本考点主要考查了仪器的名称、气体的制取装置和收集装置的选择,同时也考查了化学方程式的计算和气体的除杂等,综合性比较强。气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关。
①仪器I的名称是锥形瓶;锌与稀盐酸反应生成氯化锌和氢气,化学化学方程式是:Zn+2HCl=ZnCl2+H2↑,氢气的密度小于水,若B装满水,用于收集A生成的 H2,则a接 c;
②实验室用A制 O2所用药品是MnO2和过氧化氢溶液,过氧化氢在MnO2的催化下分解生成水和氧气,反应的方程式为:2H2O2![]() 2H2O+O2↑;
2H2O+O2↑;
③ 二氧化碳的密度大于空气,装置 B 收集 CO2,应从b端通入,验满时,燃着木条应放在c端。
④ 盐酸具有挥发性,制得的二氧化碳气体混有少量的氯化氢气体。装置C、E中溶液变浑浊,D中溶液不变浑浊,则原石灰水未变浑浊的原因是制得的 CO2气体中含有HCl气体, 装置D的作用是检验HCl是否除尽,E 中石灰水变浑浊是由于氢氧化钙与二氧化碳反应生成碳酸钙和水的缘故,化学方程式是CO2+Ca(OH)2=CaCO3↓+H2O;
⑤碳酸钙的质量= 0.4mol×100g/ mol =40g,
设:生成二氧化碳的质量x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
40g x
![]() x=17.6g
x=17.6g
答:生成二氧化碳的质量为17.6g。

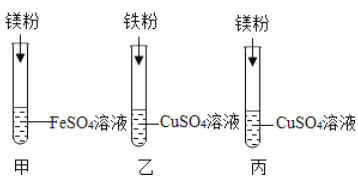
【题目】碳酸钠是苏打的主要成分,在生产和生活中有许多重要的用途。化学课上,同学们为了解碳酸钠的性质,将一定质量的碳酸钠和稀硫酸混合,充分反应后,有气体逸出,写出该反应的化学方程式_________________________________________,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外可能还含有其他成分,因此进行了猜想并做了如下实验:
【实验用品】pH试纸、锌片、氧化铜粉末,稀硫酸、氢氧化钠溶液、氯化钡溶液。
【猜想与假设】反应后溶液中溶质的可能组成成分
猜想一: ______________ 猜想二:硫酸钠、碳酸钠 猜想三:硫酸钠、硫酸
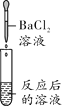
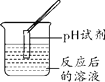
【实验探究】同学们取反应后的溶液用不同方案进行如下实验,请根据结论完成下表实验现象中的①②③。
实验方案 | A | B | C | D |
实验操作 |
|
|
|
|
实验现象 | ______ | 产生白色沉淀 | 试纸变色,对照标准比色卡,pH____7 | ______ |
实验结论 | 猜想二不正确 | 猜想三正确 | 猜想三正确 | 猜想三正确 |
【得出结论】猜想三正确。
【评价反思】(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在一处明显操作错误是:_______________________;
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由________________。
【总结提高】依据所给实验用品,设计不同的方案确认猜想三是正确的。请你写出你的实验方案_______________。
【题目】实验设计是化学实验的重要环节。请根据下列实验要求回答相关问题:
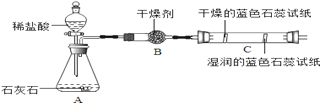
(1)【活动与探究一】用对比实验方法探究二氧化碳的性质。
实验一 | 实验二 |
|
|
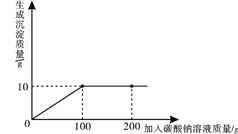
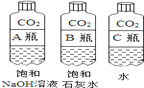
①实验一中振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度由大到小顺序为___________,B瓶内变浑浊的化学方程式为________________________。
②实验二观察到C装置中发生的现象是____________、 ________ , 结论是________________ (用化学方程式表示)。
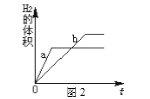
(2)【活动与探究二】定量测定空气中氧气的含量。
实验三 | |
|
|
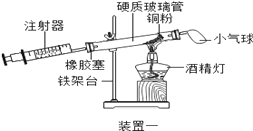
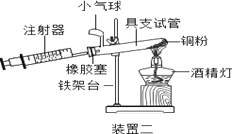
①实验三中,反应的原理为__________________ (用化学方程式表示);
②装置一比装置二更合理,理由是__________。
根据下表提供的实验数据,完成下表:
硬质玻璃管中空气体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气体积分数 |
30mL | 20mL | 10mL | ③_________ |
④定量实验操作中易产生误差,如果反应前气球中存在气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果________ (填“偏小”、“偏大”或“无影响”)。