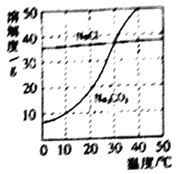
题目内容
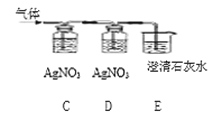
【题目】某化学兴趣小组同学要探究镁、铁、铜三种金属的活动性顺序,设计了下图所示的实验方案:
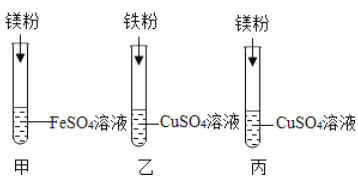
(1)乙试管中反应的化学方程式为____________________________________;
(2)同学们经讨论后认为该方案可以优化,______试管的实验是多余的,并通过观察实验现象,得出三种金属的活动性由强到弱的顺序为________________________
(3)去掉多余的实验,同学们将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后,过滤,得到滤渣和滤液,然后对滤渣的成分进行如下探究:
【提出问题】烧杯中滤渣的成分是什么?
【实验探究】向过滤得到的滤渣中加稀硫酸,①若无气泡产生,则滤渣的成分是______;②若有气泡产生,则滤渣中一定含有____________。
【答案】 Fe + CuSO4 = FeSO4 + Cu 丙 Mg>Fe>Cu Cu Cu、Fe或Cu、Fe、Mg
【解析】本题考查了金属活动性的探究和反应后的所得固体的成分。
(1)乙试管中,若铁丝表面出现红色物质,溶液由蓝色变成浅绿色,可证明铁的活动性强于铜,该反应的化学方程式为:Fe+CuSO4═FeSO4+Cu;
(2)实验甲能判断镁的活动性大于铁,乙能判断出铁的活动性大于铜,丙实验多余,三种金属的活动性由强到弱的顺序为Mg>Fe>Cu;
(3)将另两只试管中反应后的物质倒入同一大烧杯中,一段时间后过滤,向滤渣中加入稀硫酸,①若无气泡产生,则滤渣的成分是,说明没有镁与铁,一定含有Cu;②若有气泡产生,说明有活泼金属存在所以滤渣中一定有Cu、Fe或Cu、Fe、Mg。

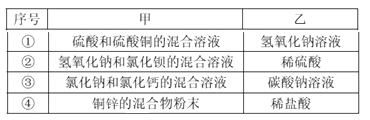
【题目】下列关于反应类型和物质类别的判断不完全正确的是( )
选项 | 化学方程式 | 反应类型 | 所选物质类别 |
A | FeCl3+3NH3H2O=Fe(OH)3↓+3NH4Cl | 复分解反应 | NH3H2O是碱 |
B | 3C+2Fe2O3 | 置换反应 | Fe是金属单质 |
C | 4NO2+O2+2H2O═4HNO3 | 化合反应 | HNO3是酸 |
D | 2KClO3 | 分解反应 | KClO3是氧化物 |
A. A B. B C. C D. D