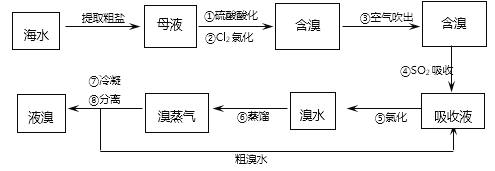
题目内容
【题目】图1所示是甲、乙、丙、丁四种常见金属在容器中与盐酸的反应情况,卡通人周围的小黑点表示反应中生成的气泡。
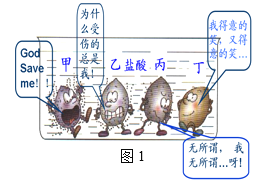
(1)四种金属的活动性顺序由强到弱可排列为___________________;
(2)若完全反应后,金属乙有余,且表面已无气泡,则此时溶液中的溶质有________种;
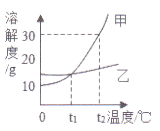
(3)若酸足量,图2中a、b分别表示其中两种金属的反应情况,则a、b可能是_______(填序号)。
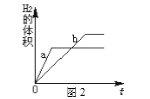
A.a为Mg b为Al B.a为Zn b为Fe
C.a为Mg b为Fe D.a为Zn b为Mg
【答案】 甲> 乙 > 丙> 丁 2种 AB
【解析】(1)图中金属甲表面气泡最多,其次为金属乙,最少的为金属丙,金属丁表面无气泡,所以甲乙丙丁四种金属活动性由强到弱的顺序为:甲、乙、丙、丁;(2)根据图中的现象可知,甲、乙、丙会与酸反应,丁不会与酸反应,乙有剩余,乙会将丙从其盐溶液中置换出来,所以溶液中只有甲、乙的盐溶液,所以此时溶液中的溶质有2种;(3)从图象可以看出,a比b活泼,b生成的氢气比a多,说明相同化合价时,b的相对原子质量比a小,
A、镁比铝活泼,24份质量的镁会生成2份质量的氢气,54份质量的铝会生成6份质量的氢气,相同质量的铝生成的氢气比镁多,符合题意,正确;B、锌比铁活泼,56份质量的铁生成2份质量的氢气,65份质量的锌生成2份质量的氢气,相同质量的铁生成的氢气比锌多,符合题意,正确;C、镁比铁活泼,24份质量的镁会生成2份质量的氢气,56份质量的铁生成2份质量的氢气,相同质量的镁生成的氢气比铁多,不符合题意,错误;D、镁比锌活泼,不符合题意,错误。故选AB。

练习册系列答案
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案
相关题目