题目内容
【题目】碳酸钠是苏打的主要成分,在生产和生活中有许多重要的用途。化学课上,同学们为了解碳酸钠的性质,将一定质量的碳酸钠和稀硫酸混合,充分反应后,有气体逸出,写出该反应的化学方程式_________________________________________,同学们对反应后溶液中溶质的成分进行了探究:认为除一定含有硫酸钠外可能还含有其他成分,因此进行了猜想并做了如下实验:
【实验用品】pH试纸、锌片、氧化铜粉末,稀硫酸、氢氧化钠溶液、氯化钡溶液。
【猜想与假设】反应后溶液中溶质的可能组成成分
猜想一: ______________ 猜想二:硫酸钠、碳酸钠 猜想三:硫酸钠、硫酸
【实验探究】同学们取反应后的溶液用不同方案进行如下实验,请根据结论完成下表实验现象中的①②③。
实验方案 | A | B | C | D |
实验操作 |
|
|
|
|
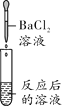
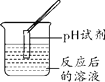
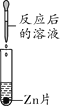
实验现象 | ______ | 产生白色沉淀 | 试纸变色,对照标准比色卡,pH____7 | ______ |
实验结论 | 猜想二不正确 | 猜想三正确 | 猜想三正确 | 猜想三正确 |
【得出结论】猜想三正确。
【评价反思】(1)老师对同学们能用多种方案进行探究,并且得出正确的实验结论给予了肯定,同时指出探究中存在一处明显操作错误是:_______________________;
(2)有同学对实验方案B的结论提出了质疑,认为仅凭此现象不能得出猜想三正确,请说明理由________________。
【总结提高】依据所给实验用品,设计不同的方案确认猜想三是正确的。请你写出你的实验方案_______________。
【答案】 Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 硫酸钠 无现象 < 有气泡产生,锌片不断溶解 方案C中pH试纸浸入溶液中 溶液中的硫酸钠与氯化钡反应也会产生白色沉淀,不能证明反应后的溶液中一定是否有硫酸存在 取少量氧化铜粉末于试管中,加入足量反应后的溶液,若氧化铜溶解,溶液变蓝,则猜想三正确。
【解析】本题考查了反应后溶液中溶质成分,酸和盐的性质,溶液酸碱度的测定。反应后溶液中溶质的成分中一定含有反应生成的可溶物,可能存在过量的可溶性反应物。
(1)碳酸氢钠和稀硫酸混合反应生成硫酸钠、水和二氧化碳,该反应的化学方程式Na2CO3+H2SO4=Na2SO4+H2O+CO2↑;
猜想与假设:反应后溶液中溶质的成分中一定含有反应生成硫酸钠,还有可能过量的硫酸或碳酸钠,所以猜想一是硫酸钠;
实验探究:猜想二不正确,说明无碳酸钠,加入硫酸不会产生气体,猜想三正确,说明含有硫酸,测得的pH<7,加入锌片则稀硫酸与锌反应产生氢气,所以现象是:有气泡产生,锌片不断溶解;
评价反思:(1)根据图示可以看出,C实验中将pH试纸直接浸入待测液,会污染试剂,操作错误;
(2) 溶液中的硫酸钠与氯化钡反应也会产生白色沉淀,不能证明反应后的溶液中一定是否有硫酸存在;
总结提高:要设计不同的方案确认猜想三是正确的,可以利用酸与金属氧化物的反应,取少量氧化铜粉末于试管中,加入足量反应后的溶液,若氧化铜溶解,溶液变蓝,则猜想三正确。

 轻松暑假总复习系列答案
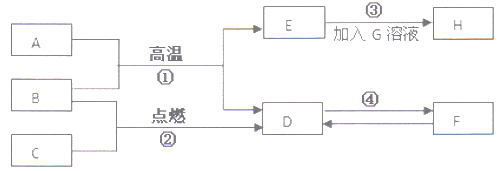
轻松暑假总复习系列答案【题目】下列有关化学反应类型的判断,错误的是
选项 | 化学方程式 | 反应类型 |
A | 4Fe(OH)2+O2+2H2O = 4Fe(OH)3 | 化合反应 |
B | 2NaHCO3 | 分解反应 |
C | BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2 | 复分解反应 |
D | Fe3O4+4CO | 置换反应 |
A. A B. B C. C D. D