题目内容
(8分)某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0 g石灰石样品,把25.0g质量分数为10%的稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:
|
实验次数 |
1 |
2 |
3 |
4 |
5 |
|
稀盐酸的累计加入量 |
5.0g |
10.0g |
15.0g |
20.0g |
25.0 g |
|
剩余固体的质量 |
1.5g |
1.0g |
0.5g |
0.3g |
0.3g |
请计算:
(1)2.0g石灰石样品中碳酸钙的质量为 ,石灰石中碳酸钙的质量分数为 。
(2)请你继续计算反应生成溶液中氯化钙的质量分数(计算过程和结果均保留一位小数)。
(1)1.7g 85% (2)7.3%
【解析】
试题分析:(1)根据题意,反应剩余的固体的质量,即是杂质的质量,再由杂质的质量可计算出石灰石中碳酸钙的质量,从而由碳酸钙的质量可计算出石灰石中碳酸钙的质量分数。根据表格中的数据分析可知,最后剩余的0.3g为杂质质量,所以石灰石中碳酸钙的质量为2.0g-0.3g=1.7g,则石灰石中碳酸钙的质量分数为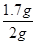 ×100%=85%。
×100%=85%。
(2)由碳酸钙的质量,结合化学方程式,可计算出生成的氯化钙的质量和二氧化碳的质量,进而计算出生成溶液中氯化钙的质量分数。
设反应生成CaCl2的质量为x,CO2的质量为y 。
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 111 44
1.7g x y
 解得,x=1.9g
解得,x=1.9g
 解得,y=0.7g
解得,y=0.7g
则反应后所得溶液的质量=1.7g+25g-0.7g=26g
所以,反应后的氯化钙的溶质质量分数=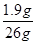 ×100%=7.3%。
×100%=7.3%。
答:反应后生成的溶液中氯化钙的溶质质量分数为7.3% 。
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
点评:此题是关于化学方程式及溶质质量分数的计算题,要求学生要有较强的分析能力和数据处理能力;解题的关键是,要会利用化学反应,并结合表格中的数据分析判断出杂质的质量(这是本题所隐藏的关键条件),从而判断出样品中碳酸钙的质量;然后再根据相关的化学反应方程式,并依据已知量对未知的应求量进行求解计算即可,注意解题要规范。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加入稀硫酸质量(g) | 200 | 200 | 200 | 200 |
| 剩余固体质量(g) | 37.6 | 15.2 | 4 | 4 |
(说明:生铁中杂质不溶于水,也不与硫酸反应.)
(1)第2次测得剩余固体质量为15.2g,其成分为
A.铁 B.铁和碳 C.碳
(2)生铁中铁的质量分数为多少?(写出计算过程,结果保留到小数点后一位)
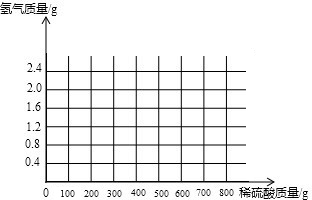
(3)计算所用稀硫酸的溶质质量分数为多少?(写出计算过程,结果保留到小数点后一位)并画出反应生成的氢气质量与加入稀硫酸质量的关系图.
| 反应时间/分 | 0 | 2 | 4 | 6 | 8 | 10 |
| 烧杯及所盛物质质量/克 | 80.0 | 79.0 | 78.3 | 77.9 | 77.8 | 77.8 |
(2)该石灰石样品中碳酸钙的质量分数是多少?
 某化学兴趣小组为了粗略测定一批石灰石样品中CaCO3的质量分数,设计并进行如下实验.实验装置如图所示,称取研细的2.60g石灰石样品,分4次加入稀盐酸,充分反应至不再产生气体为止.测得反应前后的有关质量如表:
某化学兴趣小组为了粗略测定一批石灰石样品中CaCO3的质量分数,设计并进行如下实验.实验装置如图所示,称取研细的2.60g石灰石样品,分4次加入稀盐酸,充分反应至不再产生气体为止.测得反应前后的有关质量如表: