题目内容
某化学兴趣小组为了粗略测定一批石灰石样品中CaCO3的质量分数,设计并进行如下实验。
实验装置如图所示,称取研细的2.60g石灰石样品,分4次加入稀盐酸,充分反应至不再产生气体为止。测得反应前后的有关质量如表:


(1)计算石灰石样品中CaCO3的质量分数。
(2)若在上述实验过程中石灰石样品和所加酸液均无抛洒,根据图中装置判断,该实验结果可能??? (填“偏大”、“偏小”或“准确”),原因是??? 。
【答案】
(1)76.9%
(2)偏小,有二氧化碳溶解在水中或再容器中没有逸散出来
【解析】
试题分析:依据质量守恒定律化学反应前后物质的总质量不变,则减少的质量为反应生成的二氧化碳的质量。利用化学方程式中碳酸钙与二氧化碳的质量比,结合二氧化碳的质量,可求出样品中碳酸钙的质量
解:(1)104.6.g +20.00g -123.72g =0.88g
设石灰石样品中CaCO3的质量为x
CaCO3+2HCl = CaCl2 + H2O+? CO2↑???
100???????????????????????? 44
x??????????????????????? 0.88g
100/44 =X/0.88g
x =2g
碳酸钙的质量分数为:2g/2.6g ×100% = 76.9%
答:石灰石样品中CaCO3的质量分数为83.3%。
(2)由于二氧化碳溶解在水中或再容器中没有逸散出来,故会偏小。
考点:根据化学反应方程式的计算

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
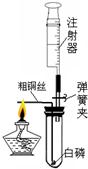
 注射器是一种普通的医疗器械,但它在化学实验中发挥着越来越大的作用.某化学兴趣小组为了测定空气中氧气的含量,进行了如下探究活动:
注射器是一种普通的医疗器械,但它在化学实验中发挥着越来越大的作用.某化学兴趣小组为了测定空气中氧气的含量,进行了如下探究活动: