题目内容
某化学兴趣小组为了分析生铁中铁的含量,进行了实验研究,即取60g经粉碎后的生铁,把800稀硫酸分4次加入到该样品中,测得数据记录如下表:| 第1次 | 第2次 | 第3次 | 第4次 | |
| 加入稀硫酸质量(g) | 200 | 200 | 200 | 200 |
| 剩余固体质量(g) | 37.6 | 15.2 | 4 | 4 |

(说明:生铁中杂质不溶于水,也不与硫酸反应.)
(1)第2次测得剩余固体质量为15.2g,其成分为
A.铁 B.铁和碳 C.碳
(2)生铁中铁的质量分数为多少?(写出计算过程,结果保留到小数点后一位)
(3)计算所用稀硫酸的溶质质量分数为多少?(写出计算过程,结果保留到小数点后一位)并画出反应生成的氢气质量与加入稀硫酸质量的关系图.
分析:(1)首先分析图表可发现向第二次的剩余固体中加硫酸,固体继续减少,说明第二次剩余固体中铁剩余,当然碳不反应,也剩余,且碳的质量为4g.
(2)分析图表可得出碳的质量为4g.
(3)分析图表可得出结论:每200g硫酸可以反应37.6-15.2=22.4g铁,可根据化学方程式计算出22.4g铁反应的硫酸的质量.
(2)分析图表可得出碳的质量为4g.
(3)分析图表可得出结论:每200g硫酸可以反应37.6-15.2=22.4g铁,可根据化学方程式计算出22.4g铁反应的硫酸的质量.
解答:解:(1)分析图表可发现向第二次的剩余固体中加硫酸,固体继续减少,说明第二次剩余固体中铁剩余,当然碳不反应,也剩余.
故答案为:B
(2)分析图表可知最终剩余固体的4g为碳.
所以生铁中铁的质量分数为:
×100%=93.3%
(3)分析图表可得出结论:每200g硫酸可以反应37.6-15.2=22.4g铁,
设200g稀硫酸中的溶质质量为x,22.4g铁反应生成氢气的质量为y则
Fe+H2SO4 =FeSO4+H2↑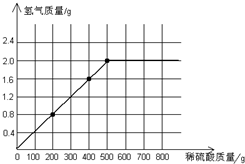
56 98 2
22.4g x y
=
=
解之得:x=39.2g,y=0.8g
稀硫酸的溶质质量分数为:
×100%=19.6%
可得出56g铁反应生成氢气的质量为0.8g×
=2g,恰好反应消耗的硫酸质量为500g
由于铁和硫酸反应生成氢气的质量和反应的500g硫酸成正比,所以图象如上:
答:生铁中铁的质量分数为93.3%,稀硫酸的溶质质量分数为19.6%.
故答案为:B
(2)分析图表可知最终剩余固体的4g为碳.
所以生铁中铁的质量分数为:
| 60-4 |
| 60 |
(3)分析图表可得出结论:每200g硫酸可以反应37.6-15.2=22.4g铁,
设200g稀硫酸中的溶质质量为x,22.4g铁反应生成氢气的质量为y则
Fe+H2SO4 =FeSO4+H2↑

56 98 2
22.4g x y
| 56 |
| 22.4g |
| 98 |
| x |
| 2 |
| y |
解之得:x=39.2g,y=0.8g
稀硫酸的溶质质量分数为:
| 39.2g |
| 200g |
可得出56g铁反应生成氢气的质量为0.8g×
| 56 |
| 22.4 |
由于铁和硫酸反应生成氢气的质量和反应的500g硫酸成正比,所以图象如上:
答:生铁中铁的质量分数为93.3%,稀硫酸的溶质质量分数为19.6%.
点评:本题有一定的难度,要求学生分析数据,筛选信息,并利用数据根据化学方程式进行的计算.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某化学兴趣小组为了测定某石灰石样品中碳酸钙的质量分数,取用2.0 g石灰石样品,把25.0g质量分数为10%的稀盐酸分五次加入样品中(样品中的杂质既不与盐酸反应,也不溶解于水),每次充分反应后都经过滤、干燥、称量,得实验数据如下:
请计算:
(1)2.0g石灰石样品中碳酸钙的质量为 ,石灰石中碳酸钙的质量分数为 .
(2)请你继续计算反应生成溶液中氯化钙的质量分数(计算过程和结果均保留一位小数).
| 实验次数 | 1 | 2 | 3 | 4 | 5 |
| 稀盐酸的累计加入量 | 5.0g | 10.0g | 15.0g | 20.0g | 25.0 g |
| 剩余固体的质量 | 1.5g | 1.0g | 0.5g | 0.3g | 0.3g |
(1)2.0g石灰石样品中碳酸钙的质量为
(2)请你继续计算反应生成溶液中氯化钙的质量分数(计算过程和结果均保留一位小数).