题目内容
【题目】“酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,智慧小组同学利用该工具进行探究学习。部分酸、碱和盐的溶解性表(室温)
阴离子 阳离子 | OH﹣ | NO3﹣ | Cl﹣ | SO42﹣ | CO32﹣ |
K+ | 乙 | 丁 | 戊 | ||
Ba2+ | 甲 | 丙 |
探究活动一:认识工具
如上图,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。
(1)认识符号:NO3﹣名称是_____;
(2)物质分类:五种物质中,属于碱的是_____(用化学式表示);
(3)溶解能力:五种物质中,只有一种不溶于水,它是_____(用化学式表示);
(4)相互反应:五种物质中,在溶液中能相互反应的两种物质是_____(用化学式表示)。
探究活动二:运用工具
已知某氯化钠样品中,含有不溶性杂质(泥沙)和可溶性杂质(氯化镁、氯化钙)。为了得到纯净的氯化钠,某实验小组设计了下列实验方案,请你完成相关问题:
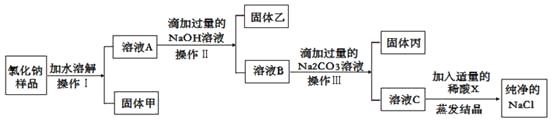
(1)在上述实验方案中,操作Ⅰ、操作Ⅱ、操作Ⅲ都是将固体和溶液分离,该操作是实验基本操作中的_____。
(2)固体乙是_____,溶液B中的溶质有_____。(都用化学式表示)
(3)通过上述设计可以看出,除去氯化钠中的可溶性杂质,实质上就是加入试剂把溶液中的_____(填离子符号)转化为难溶于水的物质,再进行分离而除去。在溶液C中加入适量的稀酸X是为了把加入的过量试剂反应掉,写出其中一个反应的化学方程式_____。
【答案】硝酸根离子 Ba(OH)2 BaSO4 K2CO3、Ba(OH)2 过滤 Mg(OH)2 CaCl2、NaCl、NaOH Mg2+、Ca2+ NaOH+HCl=NaCl+H2O或Na2CO3+2HCl=2NaCl+H2O+CO2↑
【解析】
探究活动一:认识工具
(1)NO3-名称是硝酸根离子;
(2)碱是指电离时生成的阴离子全部是氢氧根离子的化合物,所以五种物质中,属于碱的是甲(氢氧化钡)化学式为:Ba(OH)2;
(3)五种物质中,硫酸钡不溶于水,化学式为:BaSO4;
(4)碳酸钾与氢氧化钡反应生成碳酸钡沉淀和氢氧化钾。五种物质中,在溶液中能相互反应的两种物质是碳酸钾、氯化钡,化学式分别为:K2CO3、Ba(OH)2;
探究活动二:运用工具
(1)过滤是把不溶于液体的固体物质跟液体分离开来的一种混合物分离的方法。在上述实验方案中,操作Ⅰ、操作Ⅱ、操作Ⅲ都是将固体和溶液分离,该操作是实验基本操作中的过滤;
(2)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,固体乙是Mg(OH)2;溶液B中的溶质有没有参加反应的氯化钙、生成的氯化钠和过量的氢氧化钠,化学式分别为:CaCl2、NaCl、NaOH。
(3)氢氧化钠和氯化镁反应生成氢氧化镁沉淀和氯化钠,碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠。通过上述设计可以看出,除去氯化钠中的可溶性杂质,实质上就是加入试剂把溶液中的Mg2+、Ca2+转化为难溶于水的物质,再进行分离而除去;碳酸钠与盐酸反应生成氯化钠、水和二氧化碳,氢氧化钠与盐酸反应生成氯化钠和水,在溶液C中加入适量的稀酸X是为了把加入的过量试剂反应掉,反应的化学方程式分别为:NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+H2O+CO2↑。

【题目】某同学为了测定生铁样品中铁的质量分数,将60g 稀盐酸分3次加入到盛有4g 该样品的烧杯中(样品中只有铁与稀盐酸反应),所得数据如表,则下列说法中正确的是( )
实验次数 物质质量 | 第1次 | 第2次 | 第3次 |
加入稀盐酸的质量/g | 20 | 20 | 20 |
充分反应后剩余固体的质量 | 2.6 | 1.2 | 0.1 |
A. 第1次和第2次产生氢气的质量不同
B. 第2次和第3次剩余固体中均有铁
C. 第3次充分反应后溶液中溶质只有FeCl2
D. 生铁样品中铁的质量分数为97.5%