题目内容
【题目】(7分)A~N是初中学过的物质。D是相对分子质量为40的氧化物,A是不溶于稀硝酸的白色沉淀,E是难溶于水的白色沉淀,实验室通常用N制取CO2。下图是这些物质的转化关系,部分反应物、生成物及反应条件已省略。(注:难溶性碱加热分解生成对应的氧化物)
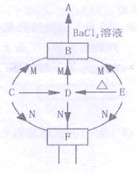
(1)写出化学式:A ,N 。
(2)写出E→B的化学反应方程式 。
(3)由F生成E需加入的物质是 。
(4)C在空气中燃烧生成D的实验现象是 。C在空气中燃烧除了生成D 之外,也可能与空气中的氮气生成氮化物(氮元素化合价为-3),该氮化物的化学式是 。
【答案】(1)BaSO4 HCl (2)Mg(OH)2+H2SO4 = MgSO4+2H2O
(3)NaOH或KOH等 (4)发出耀眼的白光,产生白烟,生成白色固体 Mg3N2
【解析】
试题分析:D是相对分子质量为40的氧化物说明D是氧化镁,因此C是镁,C在空气中燃烧生成D的实验现象是发出耀眼的白光,产生白烟,生成白色固体,C在空气中燃烧除了生成D之外,也可能与空气中的氮气生成氮化物(氮元素化合价为-3),因为镁的化合价为+2价,所以该氮化物的化学式是Mg3N2;实验室通常用N制取CO2且D能够和N反应,说明N是盐酸,A是物质和氯化钡反应的结果,所以A是硫酸钡沉淀,E是难溶于水的白色沉淀,且加热会产生氧化镁,所以E是氢氧化镁,B是E获得的使用B是硫酸镁,因此写出E→B的化学反应方程式Mg(OH)2+H2SO4 = MgSO4+2H2O;F是由D和N反应获得,所以F是氯化镁,由F生成E需加入的物质是一种可溶性的碱,所以需加入的物质是NaOH或KOH等。

练习册系列答案
相关题目