��Ŀ����
����Ŀ����10�����ش�ʵ�����ø��������ȡ������������⡣
��1��д����ȡԭ���Ļ�ѧ����ʽ��__________________________��
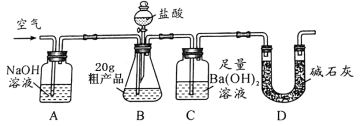
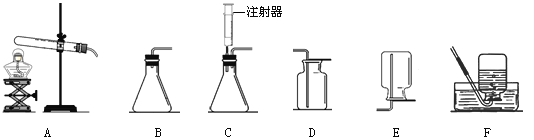
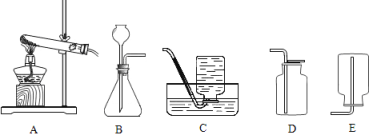
��2������ͼ��ʾ������װ��Ӧѡ��_____________�����ţ���ͬ�������������ռ�װ�ò��ܲ��õ���_____________��
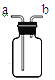
��3��Ϊ�ⶨ������طֽ����������������Ӧѡ����ͼװ��_____________����������
��4��ʵ�������ijͬѧ�����ռ����Ĵ�������������ͨ����ѧ����ʽ��������������������ʵ��������ʹ����һ�ֲ��벢�����Ӧ��֤������_______________________��
���𰸡���1��2KMnO4 ��K2MnO4 + MnO2 + O2������2��A��E;��3������
��4���տ�ʼ�����ݾ��ռ����壻����ȡ������ع��壬���ȣ�����������������ʱ�ռ��������������������жԱ�
��������
�����������1���ø��������ȡ�����Ļ�ѧ����ʽΪ2KMnO4 ��K2MnO4 + MnO2 + O2������2����Ϊ���������ȡ��������Ӧ���״̬Ϊ���壬��Ӧ����Ϊ���ȣ���ѡ����������װ��A�����ɵ�������������ˮ���ܶȱȿ����ʲ��˲��������ſ������ռ�����3��Ϊ�ⶨ������طֽ����������������Ӧ�ñ�֤���ɵ������ˮ�Ӽ���ƿ��ѹ����Ͳ�У�������̽���ˮ�ӳ�������������ѡ���װ�ã���4���տ�ʼ�����ݾ��ռ����壻����ȡ������ع��壬���ȣ�����������������ʱ�ռ��������������������жԱȡ�