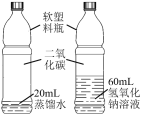
题目内容
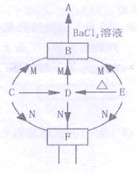
【题目】(7分)现代循环经济要求综合考虑环境污染和经济效益。高纯氧化铁可作现代电子工业的材料,以下是用硫铁矿烧渣(主要成分为Fe2O3、FeO、SiO2)为原料制备高纯氧化铁(Fe2O3)的生产流程示意图:[(NH4)2CO3溶液呈碱性,40 ℃以上时(NH4)2CO3分解]。
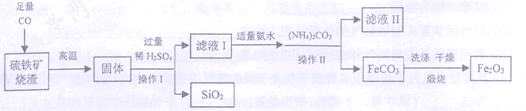
(1)实验室中,操作Ⅰ、操作Ⅱ用到的玻璃仪器有玻璃棒、烧杯、 等。
(2)滤液Ⅰ中主要的阳离子是 等。
(3)加适量氨水的目的是 。
(4)根据题中信息,加入(NH4)2CO3后,该反应必须控制的条件是 。
(5)滤液Ⅱ中可回收的产品是 (写化学式)。
(6)写出在空气中煅烧FeCO3的化学反应方程式 。
【答案】(1)漏斗 (2)H+ Fe2+ (3)中和过量的H2SO4
(4)控制溶液的温度在40℃以下(5)(NH4)2SO4 (6)4FeCO3+O2 ![]() 2Fe2O3+4CO2
2Fe2O3+4CO2
【解析】
试题分析:实验室中,操作Ⅰ、操作Ⅱ中都是得到了固体和液体的分离因此用到的玻璃仪器有玻璃棒、烧杯、漏斗,)滤液Ⅰ中主要的阳离子是过量的酸中的氢离子和反应产生的亚铁离子,加适量氨水的目的是中和过量的H2SO4,根据题中信息,加入(NH4)2CO3后,该反应必须控制的条件是控制溶液的温度在40℃以下因为(NH4)2CO3溶液呈碱性,40 ℃以上时(NH4)2CO3分解,而反应中溶液酸碱度也必须控制,因为碱性过强有可能生成氢氧化亚铁,酸性过强就不可能得到碳酸盐;滤液Ⅱ中可回收的产品是(NH4)2SO4;煅烧FeCO3的化学反应方程式4FeCO3+O2 ![]() 2Fe2O3+4CO2
2Fe2O3+4CO2

【题目】某腐蚀印刷电路板的废液中含有CuCl2和FeCl2,为了分析该废液的组成,取1 000 g废液,设计如下实验方案进行探究:
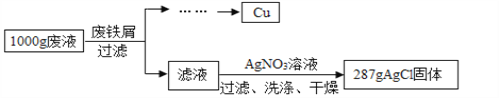
实验过程中加入废铁屑的质量、析出Cu的质量的数据记录如下表:
废铁屑的质量/g | 20 | 40 | 60 | 80 |
析出Cu的质量/g | 12.8 | 25.6 | 32 | 32 |
(注:废铁屑中的杂质不溶于废液也不与废液反应,不考虑过滤中的损失。)
(1)1 000 g废液与足量废铁屑完全反应,析出Cu的质量为_______ g。
(2)废铁屑中单质Fe的质量分数为_______________。
(3)计算1 000 g废液中CuCl2的质量分数_______。(写出计算过程,结果保留小数点后一位)
(4)1 000 g废液中FeCl2的质量分数为_________。(结果保留小数点后一位)