题目内容
【题目】水是生命之源,“珍惜水、节约水、保护水”是每个公民的义务和责任.
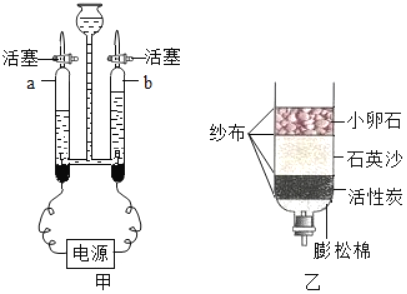
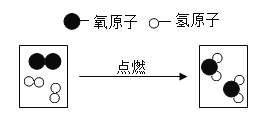
(1)用如图甲装置进行电解水的实验,a中收集到的气体是_____.检验方法是_____.
(2)我国很多农村村民用地下水作为生活用水,人们常用_____检验地下水是硬水还是软水;生活中可用_____的方法降低水的硬度;某同学自制如图乙所示简易净水器,图中活性炭的主要作用是_____.
(3)高铁酸钾(K2FeO4)是一种新型、高效的多功能水处理剂.高铁酸钾受热时发生的反应为4K2FeO4![]() 2R+4K2O+3O2↑,则R的化学式是_____.
2R+4K2O+3O2↑,则R的化学式是_____.
(4)请举一例生活中节约用水的具体措施_____.
【答案】氧气 把带火星的木条放到a管管口,打开活塞,带火星的木条复燃 肥皂水 煮沸 吸附色素和异味 Fe2O3 用淘米水浇花、用洗衣服的水冲马桶等
【解析】
(1)电解水的实验,a中收集到的气体体积较少,是氧气,氧气具有助燃性,能使带火星的木条复燃,检验方法是:把带火星的木条放到a管管口,打开活塞,带火星的木条复燃;
(2)用肥皂水检验地下水是硬水还是软水,其中产生泡沫较多的是软水,泡沫较少的是硬水;生活中可用煮沸的方法降低水的硬度,活性炭具有吸附性,除去色素和异味;
(3)根据质量守恒定律和4K2FeO4![]() 2R+4K2O+3O2↑可知,每个R中含有2个铁原子和3个氧原子,R是氧化铁,化学式可以表示为Fe2O3;
2R+4K2O+3O2↑可知,每个R中含有2个铁原子和3个氧原子,R是氧化铁,化学式可以表示为Fe2O3;
(5)生活中节约用水的具体措施有很多,例如:用淘米水浇花、用洗衣服的水冲马桶等。

练习册系列答案
 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目