题目内容
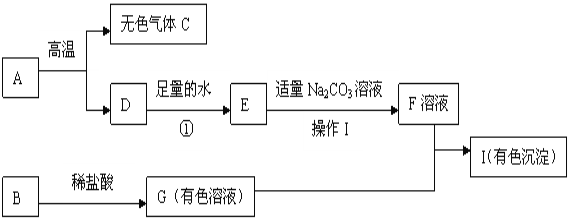
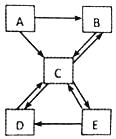
【题目】现有A~E 五种常见物质,且都含有同一种非金属元素,其中C能使澄清石灰水变浑浊,B、C组成元素相同,E溶液呈碱性,它们的转化关系如图。请回答:
(1)写出物质C的化学式:_____。
(2)E 的常见用途是_____。
(3)写出上述转化中可能涉及的化学方程式:
①分解反应:_____。
②复分解反应:_____。
【答案】CO2.制化学品、清洗剂、洗涤剂。CaCO3![]() CaO+CO2↑.Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;Na2CO3+2HCl═2NaCl+H2O+CO2↑;CaCO3+2HCl═CaCl2+H2O+CO2↑。
CaO+CO2↑.Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;Na2CO3+2HCl═2NaCl+H2O+CO2↑;CaCO3+2HCl═CaCl2+H2O+CO2↑。
【解析】
根据“A~E五种常见物质,且都含有同一种非金属元素,其中C能使澄清石灰水变浑浊,B、C组成元素相同,E溶液呈碱性”,则C为二氧化碳,B为一氧化碳,结合图框,则推测A为碳,D为碳酸钙,E为碳酸钠,代入检验,符合题意。
(1)根据分析,物质C为二氧化碳,故C的化学式:CO2;
(2)根据分析,物质碳酸钠,故E的常见用途是制化学品、清洗剂、洗涤剂;
(3)反应A→B,为碳不充分燃烧生成一氧化碳,为化合反应;
反应A→C,为碳充分燃烧生成二氧化碳,为化合反应;
反应B→C,为一氧化碳燃烧生成二氧化碳,为化合反应;
反应C→B,为二氧化碳与碳高温条件下生成一氧化碳,为化合反应;
反应C→D,为二氧化碳与氢氧化钙反应生成碳酸钙和水,不是基本反应类型;碳酸钙高温分解生成氧化钙和二氧化碳,为分解反应;
反应D→C,为碳酸钙与稀盐酸反应生成二氧化碳和氯化钙、水,为复分解反应;
反应C→E,为二氧化碳与氢氧化钠反应,不是基本反应类型;
反应E→C,为碳酸钠与稀盐酸反应生成二氧化碳和氯化钠、水,为复分解反应;
反应D→E,为碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠,为复分解反应;
故①分解反应:CaCO3![]() CaO+CO2↑;
CaO+CO2↑;
②复分解反应:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;Na2CO3+2HCl═2NaCl+H2O+CO2↑;CaCO3+2HCl═CaCl2+H2O+CO2↑。

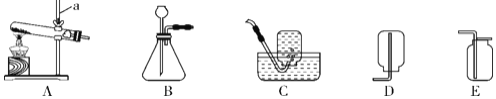
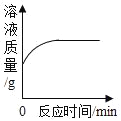
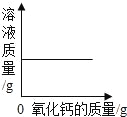
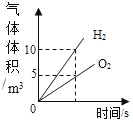
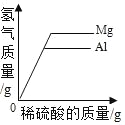
【题目】下列根据实验操作所绘制的图象中,正确的是( )
|
|
|
|
A.向一定量的硝酸银溶液中插入铜丝 | B.向一定量的饱和石灰水中加入氧化钙 | C.将水通电电解一段时间 | D.分别向等质量镁和铝中加入足量质量分数相等的稀硫酸,生成氢气质量与加入稀硫酸质量的关系 |
A. A B. B C. C D. D
【题目】取20g碳酸钠和碳酸氢钠的固体混合物,加热至不再产生气体2NaHCO3![]() Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
时间 | 0分钟 | 1分钟 | 2分钟 | 3分钟 |
仪器和浓硫酸的质量总和(g) | 150 | 150.9 | 151.8 | 151.8 |
(1)当完全反应后,生成水的质量为_____g。
(2)计算混合物中碳酸氢钠的质量分数________。(要求写出计算过程)
(3)将上述混合物完全分解后的固体溶解于186.2g 水中,待固体完全溶解后所得溶液中溶质的质量分数为_____。