题目内容
【题目】某碳酸钠样品中含有一定量的碳酸氢钠。为测定其纯度,取100 g样品加热至不再产生气体(2NaHCO3![]() Na2CO3 + H2O +CO2↑),使生成的二氧化碳完全被碱石灰吸收,测得加热时间和碱石灰质量增加的关系如下表:
Na2CO3 + H2O +CO2↑),使生成的二氧化碳完全被碱石灰吸收,测得加热时间和碱石灰质量增加的关系如下表:
时间 | 0分钟 | 1分钟 | 2分钟 | 3分钟 | 4分钟 |
仪器和碱石灰的质量总和(g) | 150 | 151.5 | 153 | 154.4 | 154.4 |
(1)当完全反应后,生成二氧化碳的质量为_____g
(2)样品中碳酸钠的质量分数是_____(写出计算过程)
(3)取另一品牌的碳酸钠样品(也含一定量的碳酸氢钠)29.6g与100g18.25%的稀盐酸恰好完全反应,将溶液蒸干可得晶体的质量为________g。
【答案】4.4 73.2% 29.25
【解析】
(1)根据质量守恒定律,反应后的总质量-反应前的总质量=生成二氧化碳的质量=154.4g-150.0g=4.4g
(2)设生成4.4g的二氧化碳需要碳酸氢钠的质量为x.
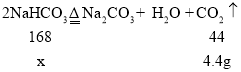
![]() 解得:x=16.8g
解得:x=16.8g
样品中碳酸钠的质量分数是:![]() ×100%=83.2%
×100%=83.2%
(3)另一品牌中的碳酸钠和碳酸氢钠与稀盐酸反应都生成了氯化钠,根据反应过程中的氯元素守恒,可得:HCl------NaCl,设反应后共生成氯化钠的质量为m
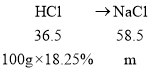
![]() 解得m=29.25g
解得m=29.25g
答:(1)当完全反应后,生成二氧化碳的质量为4.4g;
(2)样品中碳酸钠的质量分数是83.2%;
(3)取另一品牌的碳酸钠样品(也含一定量的碳酸氢钠)29.6g与100g18.25%的稀盐酸恰好完全反应,将溶液蒸干可得晶体的质量为 29.25。

练习册系列答案
 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案
相关题目