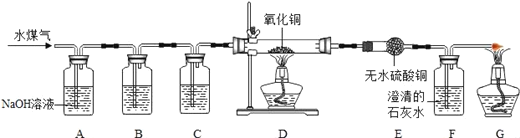
题目内容
【题目】粗盐中含有泥沙等不溶性杂质,及Ca2+、Mg2+、SO42﹣等可溶性杂质。可溶性杂质中的Ca2+、Mg2+、SO42﹣可通过加入BaCl2、NaOH和Na2CO3溶液,生成沉淀而除去,最后经过处理得到精盐。(已知:Ba2++SO42﹣=BaSO4↓、Ba2++CO32﹣=BaCO3↓、Mg2++2OH﹣=Mg(OH)2↓)
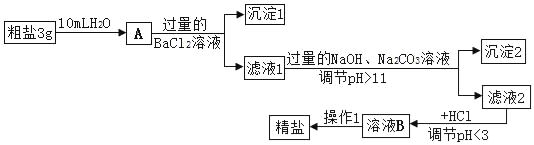
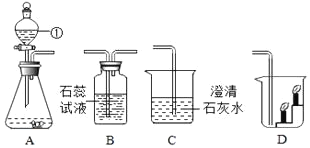
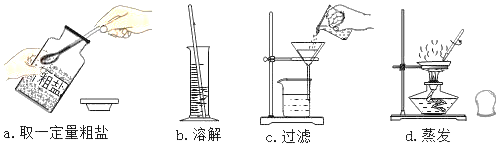
(1)如图是除去粗盐中泥沙等不溶性杂质的部分操作,其中正确的是_____(选填字母)。
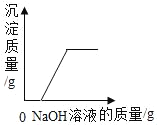
(2)在A中加入过量BaC12溶液的目的是_____。
(3)沉淀2的主要成分是_____(填化学式)。
(4)在滤液2中加盐酸调节pH<3,判断此步操作已完成方法是_____。
【答案】d 除尽SO42﹣ CaCO3、BaCO3、Mg(OH)2 取少量调节后的溶液,滴在pH试纸上,将试纸的颜色与标准比色卡对照,发现pH<3,则此步操作已完成
【解析】
(1)a取用固体药品时瓶塞要倒放在桌面上,故a错误;
b量筒不能作反应容器,溶解要在烧杯内进行,故b错误;
c过滤要用玻璃棒引流,图中没有玻璃棒,故c错误;
d蒸发时用酒精灯外焰加热,并用玻璃棒不断搅拌,故d正确;
(2)粗盐中含有泥沙等不溶性杂质,及Ca2+、Mg2+、SO42﹣等可溶性杂质,加入过量BaC12溶液,Ba2+与SO42﹣反应,可以将SO42﹣完全除尽;
(3)滤液1中含有的溶质为Ca2+、Mg2+以及过量的氯化钡,加入氢氧化钠和碳酸钠,钙离子遇到碳酸根会生成碳酸钙沉淀,镁离子遇到氢氧根会生成氢氧化镁沉淀,钡离子遇到碳酸根生成碳酸钡沉淀;
(4)判断pH<3,只需要用pH试纸检测就可以,取少量调节后的溶液,滴在pH试纸上,将试纸的颜色与标准比色卡对照,发现pH<3,则此步操作已完成;

【题目】空气中氧气含量测定的再认识。
【实验回顾】
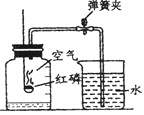
图1是实验室用红磷燃烧来粗略测定空气中氧气含量的装置。
(1)写出红磷燃烧的符号表达式 。
(2)实验原理:由于红磷燃烧消耗空气中的氧气,使瓶内气体的 减小,烧杯中水倒吸到集气瓶。
【问题提出】
有实验资料表明:燃烧过程中当氧气体积分数低于7% 时,红磷就无法继续燃烧,因此通过上述实验,测定结果与理论值往往相差较大。
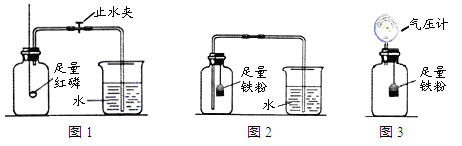
【实验改进】
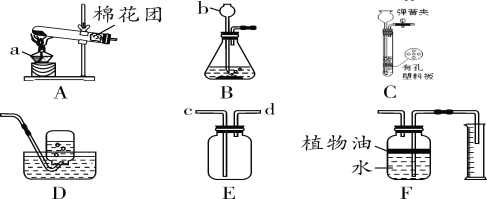
Ⅰ. 甲同学根据铁在空气中生锈的原理设计图2实验装置,再次测定空气中氧气含量(装置中装铁粉的纸袋浸有浓食盐水,会加速铁生锈)。
Ⅱ. 乙同学经过思考,在图2的基础上设计了图3实验装置,实验测得实验数据如下表:
时间/h | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
压强/KP | 101.6 | 89.7 | 85.4 | 83.3 | 82.2 | 81.] | 81.2 | 81.2 | 81.2 |
【交流表达】
(1)根据表中数据计算,改进后测得空气中氧气的体积分数是 (结果精确到0.1%)。
(2)从实验原理角度分析,图2的实验结果比图1准确度更髙的主要原因是: 。
【实验反思】
许多同学用改进前图1装置得出的结论却也与理论值相差不大,其主要原因是: