题目内容
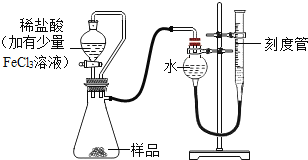
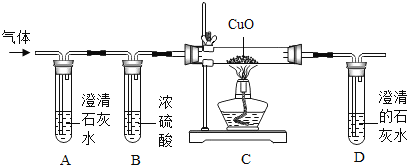
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出突出的贡献。以NH3、CO2、NaCl 等为原料先制得NaHCO3, 进而生产纯碱。该生产工艺的一个反应原理为: ![]() 。现用如下图所示装置和上述原理制取碳酸氢钠晶体,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
。现用如下图所示装置和上述原理制取碳酸氢钠晶体,C烧杯中盛有冰水,D中装有蘸稀硫酸的脱脂棉,图中夹持装置已略去。
制取碳酸氢钠晶体可供选用的药品有:①石灰石②生石灰③浓盐酸④稀盐酸⑤浓氨水⑥饱和氯化钠溶液⑦饱和碳酸氢钠溶液。
请回答下列问题:
(1)A中所选用的药品为①和_________(填序号,下同),发生反应的化学方程式为________;
(2)B中应选用的药品是________,作用是____________。
(3)E中产生NH3气体,所选用的药品为____________,能顺利产生氨气的原因是________。
(4)在实验过程中,应先向C中通入的气体的化学式是________,其原因是_____________。
(5)由E向C装置通气的导管不能插入液面以下的原因是____________________。
(6)“侯氏制碱法”最后一步用NaHCO3制备纯碱的化学方程式为____________。
【答案】④ CaCO3+2HCl=CaCl2+H2O+CO2↑ ⑦ 吸收CO2中的HCl ②⑤ 氧化钙与水反应放热,温度升高,NH3的溶解度降低 NH3 NH3在水中的溶解度大,溶解后溶液显碱性更有利于吸收CO2 NH3极易溶于水,防止通入时液体倒吸 ![]()
【解析】
(1)A装置的目的是获得原料二氧化碳。实验室使用石灰石和稀盐酸制取二氧化碳,常温下混合,生成氯化钙、水和二氧化碳。故答案为:④、CaCO3+2HCl=CaCl2+H2O+CO2↑;
(2)实验室制取的二氧化碳会含有少量挥发的HCl气体,可以用饱和的碳酸氢钠溶液除去。故答案为:⑦、吸收CO2中的HCl;
(3)E中生成氨气,则可以选择生石灰和浓氨水。因为氧化钙和水反应放出热量,温度升高,浓氨水中的氨气溶解度降低,从而得到氨气。故答案为:②⑤、氧化钙与水反应放热,温度升高,NH3的溶解度降低;
(4)制取得到的二氧化碳气体和氨气气体,应该先通氨气。因为氨气在水中的溶解度较大,氨气溶于水后形成氨水,溶液显碱性,更有利于二氧化碳的吸收。故答案为:NH3、NH3在水中的溶解度大,溶解后溶液显碱性更有利于吸收CO2;
(5)由于氨气极易溶于水,若由E向C装置通气时,导管伸入液面以下,可能会造成倒吸。故答案为:NH3极易溶于水,防止通入时液体倒吸;
(6)碳酸氢钠在加热的条件下分解为纯碱碳酸钠、水和二氧化碳。故答案为:![]() 。
。

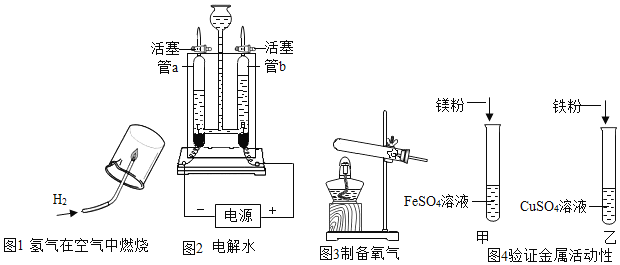
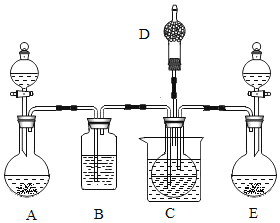
【题目】人们使用天然气(主要成分为甲烷)过程中要注意通风,如果氧气不足会产生一氧化碳,使人中毒。某兴趣小组利用图1装置,在老师指导下制取氧气和甲烷,并检验甲烷燃烧后的气体产物。
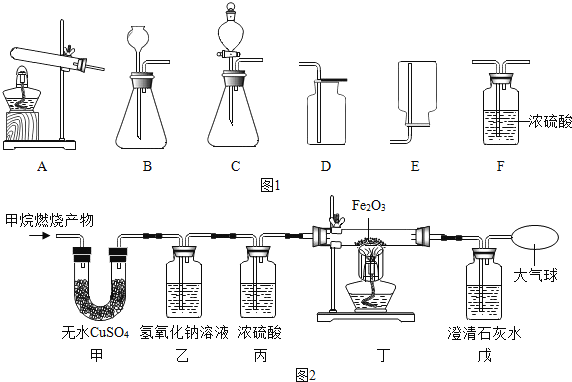
(1)小王用无水醋酸钠(化学式为CH3COONa)和碱石灰固体混合加热制取甲烷,发生装置应选择上图中的_____(填序号)。
(2)小李用一定溶质质量分数的过氧化氢溶液和二氧化锰粉末制取并收集一瓶干燥的氧气,请从上面选择装置图,正确的组装顺序为_____(填序号)。
(3)图2是小张对甲烷在氧气中燃烧后的气体产物进行验证的实验(假定每步均完全反应)。(温馨提示:无水硫酸铜吸水后变蓝,常用于验证水的存在。)请回答:
①如果将甲、乙装置顺序进行交换,则不能验证燃烧产物中的_____;
②完成实验报告:
实验操作 | 实验现象 | 实验结论 |
将甲烷燃烧后的气体产物按上图所示进行验证 | 甲装置中_____ | 燃烧产物中有H2O |
乙装置的质量增加 | 燃烧产物中有_____ | |
丁和戊装置中无明显现象 | 燃烧产物中没有CO |
③请写出该实验中甲烷燃烧的化学方程式_____。
【题目】某化学课堂进行“酸碱中和反应”实验,请你和他们一起完成实验探究。
[实验]将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是_______________。
[查阅资料]CaC12溶液显中性,Ca(OH)2溶液显碱性的原因是溶液含有_____________(用微粒符号表示)。
[提出问题]部分同学产生了疑问:反应后溶液中溶质的成分是什么?
[猜想与假设]针对疑问,甲组同学猜想如下:
猜想I:只有CaC12
猜想II:有_____________
猜想III:有CaCl2和Ca(OH)2
猜想IV:有CaCl2、HCl和Ca (OH)2
乙组同学对以上猜想提出质疑,认为猜想IV不合理,其理由是________________。
[实验探究]为了验证其余猜想,各小组进行了下列三个方案的探究。
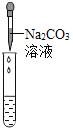
实验方案 | 滴加酚酞溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
实验现象 | _____________ | _____________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca (OH)2 | 溶液中含有Ca (OH)2 | 溶液中含有Ca (OH)2 |
[得出结论]通过探究,全班同学一致确定猜想III是正确的。
[评价反思](1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因___________________。
(2)在分析反应后所得溶液中溶质的成分时,除了考虑生成物外,还需要考虑_____________。