题目内容
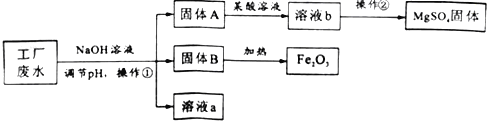
【题目】侯氏制碱法制得的纯碱样品中常含有少量氯化钠,为测定一份纯碱样品中碳酸钠的含量(假设样品只有碳酸钠和氯化钠组成),做如下实验:
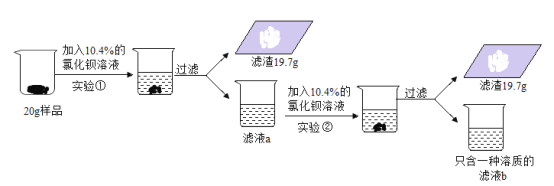
(1)上述实验过程中发生反应的化学方程式为_____;
(2)根据已知条件列出实验①中参加反应的碳酸钠质量(x)的比例式_____;
(3)样品中碳酸钠的含量为_____;
(4)两次实验消耗的氯化钡溶液的质量最简比为_____;
(5)若实验所用的氯化钡溶液是在其浓溶液中加入200g水稀释而来的,则稀释前溶液的浓度为_____;
(6)实验结束后,向滤液b中加入14.4g水,所得溶液中溶质的质量分数为_____。
【答案】Na2CO3+BaCl2=BaCO3↓+2NaCl ![]() 84.8% 1:1 20.8% 6.8%
84.8% 1:1 20.8% 6.8%
【解析】
(1)实验过程中碳酸钠和氯化钡溶液反应生成碳酸钡沉淀和氯化钠,反应的方程式为:Na2CO3+BaCl2=BaCO3↓+2NaCl;故填:Na2CO3+BaCl2=BaCO3↓+2NaCl;
(2)设参加反应的碳酸钠质量的质量为x
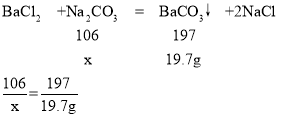
x=10.6g
故填:![]() ;
;
(3)实验①和②都生成19.7g碳酸钡沉淀,由(2)可知,样品中碳酸钠的含量为:![]()
答:样品中碳酸钠的含量为84.8%。
故填:84.8%;
(4)滤液b中只含有一种溶质,证明第二次加入的氯化钡溶液与碳酸钠恰好完全反应,又因为实验①和②都生成19.7g碳酸钡沉淀,所以实验①和②消耗氯化钡溶液的质量相同,两次实验消耗的氯化钡溶液的质量最简比为1:1。
故填:1:1;
(5)设实验①参加反应的氯化钡的质量为y,生成氯化钠的质量为z
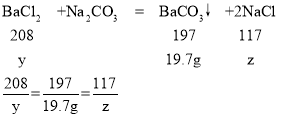
y=20.8g,z=11.7g
所以实验①加入氯化钡溶液的质量为:![]()
设稀释前溶液的浓度为a,则
a×200g=400g×10.4%
解得a=20.8%
答:则稀释前溶液的浓度为20.8%。
故填:20.8%;
(6)实验结束后,向滤液b中加入14.4g水,所得溶液中溶质的质量分数为:![]()
答:所得溶液中溶质的质量分数为6.8%。
故填:6.8%。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案