题目内容
【题目】下表是NaOH和Ca(OH)2的溶解度数据,请回答下列问题.
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 | |
溶解度(g) | NaOH | 31 | 91 | 111 | 129 | 313 | 336 |
Ca(OH)2 | 0.19 | 0.17 | 0.14 | 0.12 | 0.09 | 0.08 |
(1)从表中数据可以获得的信息是__________(写一条).
(2)把80℃时NaOH的饱和溶液降温至20℃,可以看到的现象是__________,此时溶液的溶质质量分数为__________.(保留一位小数)
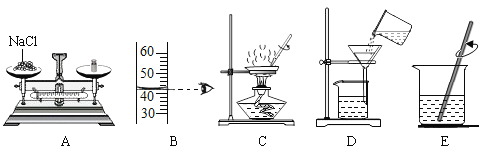
(3)某兴趣小组对部分变质的氢氧化钠固体进行提纯,设计了如下操作流程:请回答:

(Ⅰ)步骤②中加入过量Ca(OH)2的目的是__________;涉及反应的化学方程式为__________.
(Ⅱ)滤液B中的溶质是__________(写化学式);步骤③所包含的具体操作是加热浓缩、__________、过滤.
(Ⅲ)若实验前称得样品的质量为10g,实验后称得“滤渣A”和“NaOH固体”的质量分别是5g和8.7g,则此样品的纯度为__________.
【答案】氢氧化钠的溶解度随温度升高而增大 有晶体析出 47.6% 使Na2CO3充分反应 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH Ca(OH)2、NaOH 降温 47%
【解析】
(1)根据表中的数据可以看出,氢氧化钠的溶解度随温度升高而增大;
(2)把80℃时NaOH的饱和溶液降温至20℃,氢氧化钠的溶解度随温度的降低而减小,可以看到有晶体析出,![]() ;
;
(3)(Ⅰ)加入过量Ca(OH)2的目的是碳酸钠完全反应,氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
(Ⅱ)因为氢氧化钙过量,故B中含有氢氧化钙和氢氧化钠,步骤③得到了晶体,故还有降温的步骤,故填:Ca(OH)2、NaOH,降温;
(Ⅲ)设碳酸钠的质量为x

![]() x=5.3g
x=5.3g
故氢氧化钠的质量为:10g-5.3g=4.7g
此样品的纯度为![]() 。
。