题目内容
(6分)盐酸是一种重要的化工原料,也是实验室中重要的化学试剂,初中化学中许多实验都用到了盐酸。
(1)打开浓盐酸的试剂瓶,观察到瓶口有 产生。下列实验中一定不会用到盐酸的是 (填序号)。
A.除去熟石灰中的石灰石 B.鉴别氯化钠和碳酸钠
C.实验室制取二氧化碳 D.除去铁钉上的锈迹
(2)用盐酸按照下图的方式进行中和反应实验,其化学反应方程式是 ,向烧杯中逐滴滴入盐酸至过量的过程中,能够说明盐酸与氢氧化钠发生了化学反应的实验现象是 。以下证明盐酸过量的操作及实验现象的叙述正确的是 (填序号)。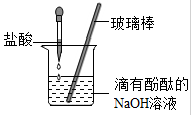
A.滴加石蕊溶液,搅拌后溶液变蓝
B.另滴加氢氧化钠溶液,搅拌后溶液颜色不变
C.加入蒸馏水,搅拌后溶液颜色不变
D.加入金属Cu片,产生气泡
(1)白雾 A(2)HCl+NaOH==NaCl+H2O 溶液红色褪去 B
解析试题分析:(1)浓盐酸有挥发性,所以当打开盛有浓盐酸的试剂瓶时,挥发出的氯化氢气体会在瓶口遇到空气中的水蒸气而溶解形成盐酸小液滴。会观察到瓶口有白雾产生。
A.盐酸可与熟石灰、石灰石都发生反应,无法单独除去石灰石。此项不正确。 B.氯化钠与盐酸不反应,无明显变化;碳酸钠可与盐酸反应生成二氧化碳气体,可观察有气泡生成。所以可用盐酸鉴别二者。此项正确。C.实验室可用盐酸和石灰石反应制取二氧化碳。此项正确。D.盐酸可用铁锈的主要成分氧化铁反应,可用于除去铁钉上的锈迹。此项正确。所以应选A项。
(2)盐酸可与氢氧化钠发生中和反应生成氯化钠和水,反应的化学方程式为:HCl+NaOH==NaCl+H2O 氢氧化钠呈碱性,可使酚酞变红。所以原烧杯中的溶液为红色。当加入盐酸的量恰好完全中和氢氧化钠时,溶液为中性,此时酚酞呈无色。此时溶液中不再含碱性物质,即可说明盐酸可与氢氧化钠反应。
当加入盐酸的量过量时,溶液应呈酸性;A. 石蕊遇酸变红,此项不正确。B.另滴加氢氧化钠溶液,搅拌后溶液颜色不变;说明加入氢氧化钠溶液后溶液仍不呈碱性。可说明溶液为酸性。此项正确。C.加入蒸馏水,搅拌后溶液颜色不变,说明溶液呈中性或酸性,此项不正确。D.在金属活动性顺序表中,铜的活动性在氢元素的后面,不能与酸反应产生气泡。此项不正确。所以应选B项。
考点:常见的酸、中和反应、酸碱的化学性质

燃煤产生的烟气中含有二氧化硫,直接排放会污染空气,它与水反应形成酸雨污染环境,某科研小组利用海水除去二氧化硫,其工艺流程见下图:
请回答下列问题:
(1)二氧化硫中硫的化合价是 。
(2)用熟石灰中和稀硫酸的化学方程式是 。
(3)亚硫酸(H2SO3)被空气中氧气氧化为硫酸,写出反应的化学方程式 。
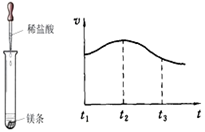
(4)为了研究脱硫率(脱硫率是已除去的二氧化硫的量占总二氧化硫量的百分比——与温度、烟气中SO2浓度的关系,他们进行了探究实验。实验结果如下:
| 实验序号 | 温度/℃ | 烟气中SO2浓度/10-2g·L-1 | 脱硫率/% |
| I | 23 | 2.5% | 99.5 |
| II | 23 | 3.2% | 97.1 |
| III | 40 | 2.5% | 94.3 |
(5)目前,科学家正在研究在一定条件下将乙烯(C2H4)和烟气混合除去二氧化硫,其反应的过程可分为如下三步:
第一步:O2与Cu+反应生成Cu+(O2)
第二步:Cu+(O2)与SO2反应生成Cu+(SO3)2
第三步:Cu+(SO3)2与C2H4反应生成S、CO2、H2O和Cu+。
①反应中Cu+的作用是 。
②除去二氧化硫的总反应的化学方程式是 。


 (5)NH3在一定的条件下能跟O2反应,反应过程可用下列示意图表示(注: 表示氮原子,●表示氧原子,0表示氢原子;各物质未配平)。请分析在该反应中参加反应的NH3与O2的分子个数之比为 。
(5)NH3在一定的条件下能跟O2反应,反应过程可用下列示意图表示(注: 表示氮原子,●表示氧原子,0表示氢原子;各物质未配平)。请分析在该反应中参加反应的NH3与O2的分子个数之比为 。
