题目内容
同学们在实验室用5%的过氧化氢溶液制取氧气并进行氧气部分性质实验,具体操作如下:
(1)溶液配制:用50mL 30%的过氧化氢溶液配制5%的过氧化氢溶液.溶液配制过程中,除用到玻璃棒外,还需用到下列仪器中的
A、托盘天平 B、烧杯 C、漏斗 D、量筒 E、胶头滴管
(2)气体制备:用配制好的5%的过氧化氢溶液和二氧化锰制取氧气.请你在如图1A、B两套装置中选择其中一套,并说明选择的理由: (合理即可).
(3)性质实验:小明用收集好的氧气,进行了铁丝燃烧的实验.实验前,它在集气瓶底部 ,然后把光亮的细铁丝盘成螺旋状,在铁丝下端系一根火柴,将火柴点燃,待火柴快燃尽时,缓慢插入集气瓶中,观察到的现象是 .
(4)拓展延伸:小亮同学在上述制取氧气的实验过程中,不小心把硫酸铜溶液滴加到了盛有5%的过氧化氢溶液中,立即产生大量气泡,于是引起了小亮同学的探究兴趣.
【提出问题】是哪种粒子能使过氧化氢分解的速率加快呢?
【查阅资料】硫酸铜溶液中含有三种粒子:H2O、SO42﹣、Cu2+
【猜想与假设】Ⅰ、不可能是H2O,理由是 ;
Ⅱ、可能是SO42﹣;
Ⅲ、可能是Cu2+.
【实验验证】如图2所示:
在实验①中加入稀硫酸后,无明显变化,说明 不能使过氧化氢的分解速率加快;
在实验②中加入 后,观察到有大量气泡产生,进一步证明能使过氧化氢分解速率加快的是 .
【结论】实验证明,硫酸铜在该反应前后的质量和化学性质都没有发生变化,硫酸铜是过氧化氢分解的催化剂.
【反思与交流】Ⅰ、检验实验②中产生气体的方法是 ;
Ⅱ、写出过氧化氢在硫酸铜催化作用下发生反应的化学方程式 .
(1)BDE;(2)A,便于添加液体药品制得较多的气体;(3)铺一层水或细沙,剧烈燃烧,火星四射,放出大量热,生成黑色固体;(4)【猜想与假设】Ⅰ、H2O2溶液中有水; 【实验验证】SO42﹣; 硫酸铜;Cu2+;【反思与交流】用带火星的木条,伸入试管,看木条是否复燃; 2H2O2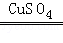 2H2O+O2↑.
2H2O+O2↑.
解析

(1)实验室可用草酸(H2C2O4)在浓硫酸的作用下分解制得一氧化碳和二氧化碳(化学方程式为:H2C2O4
 CO2↑+CO↑+H2O)。用到的实验装置见下图:
CO2↑+CO↑+H2O)。用到的实验装置见下图:
若分别得到一氧化碳和二氧化碳,请回答:
①装置A中,盛放浓硫酸的仪器名称是 ;
②收集一氧化碳时,打开a、b,关闭c,装置B的作用是 。由于一氧化碳有毒,多余的气体应 (填写具体处理办法);
③关闭 、打开 ,释放出二氧化碳,并通过装置 可收集到干燥的二氧化碳气体。
(2)在二氧化锰的催化作用下,过氧化氢迅速分解生成氧气和水。哪些因素还影响着过氧化氢分解的速率?课外活动小组结些进行了更深入的探究:
探究实验一:浓度对化学反应速率的影响
| 实验步骤 | 现 象 | 结 论 |
| 取一支试管加入3~5mL5%的过氧化氢溶液,然后加入少量二氧化锰。 | 缓慢有少量气泡冒出 | |
| 另取一支试管加入3~5mL15%的过氧化氢溶液,然后加入少量二氧化锰。 | 迅速有大量气泡冒出 |
实验用品:试管、烧杯、热水、冷水、5%过氧化氢溶液、15%过氧化氢溶液
探究实验二:温度对化学反应速率的影响
| 实验步骤 | 现 象 | 结 论 |
| | | 温度越高,过氧化氢分解的速率越大 |
| | |
关于硫酸的性质实验
① 下图是某同学组建的实验室稀硫酸与锌混合制取氢气的装置。
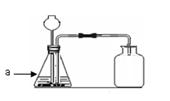 |
回答:a仪器的名称是 ;装置中用于添加液体的仪器名称是 ;装置中出现 处错误。若按照上述装置制取氢气会造成的后果是 。
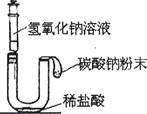
②稀硫酸与含少量氧化铁的铁粉反应实验:下图是反应的实验过程。(装置气密性良好)


写出铁与硫酸反应的化学方程式 。以上U型管中红墨水变化情况符合该实验的是 。(填写序号)
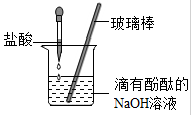
③ 中和反应实验:氢氧化钠与硫酸反应无明显现象。为了证明氢氧化钠与硫酸确实发生了化学反应,进行了如下实验:

取2mLNaOH溶液于试管中,滴入1~2滴酚酞试剂,振荡。然后,逐滴加入稀硫酸,同时不断振荡试管,整个实验过程的现象是 。由此证明,上述实验过程确实发生了化学反应。反应的化学方程式是 。