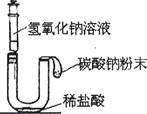
题目内容
(6分)氨水(NH3·H2O)也是常见的碱,是由NH3溶于水形成的溶液。氨水很不稳定,容易放出有刺激性气味的NH3。根据所学知识回答:
(1)NH3·H2O在水溶液中解离出来的离子有 。
(2)打开装有氨水的试剂瓶后闻到刺激性气味,说明分子 。
(3)写出NH3·H2O与稀H2SO4反应的化学方程式 。
(4)将一片有酚酞的干燥纸条和一片有酚酞的湿润纸条分别放入两瓶干燥的NH3中,现象是:
。 (5)NH3在一定的条件下能跟O2反应,反应过程可用下列示意图表示(注: 表示氮原子,●表示氧原子,0表示氢原子;各物质未配平)。请分析在该反应中参加反应的NH3与O2的分子个数之比为 。
(5)NH3在一定的条件下能跟O2反应,反应过程可用下列示意图表示(注: 表示氮原子,●表示氧原子,0表示氢原子;各物质未配平)。请分析在该反应中参加反应的NH3与O2的分子个数之比为 。
(1)NH4+、OH- (2)总是在不断运动着 (3)2NH3·H2O +H2SO4=(NH4)2SO4+2H2O
(4)有酚酞的干燥纸条不变色,有酚酞的湿润纸条变红色 (5)4∶5
解析试题分析:(1)碱是指电离时生成的阴离子全部是氢氧根离子(OH—)的化合物。NH3·H2O属于碱,所以在水溶液中解离出来的离子有NH4+、OH-。
(2)打开装有氨水的试剂瓶后闻到刺激性气味,是氨气分子从瓶中运动到人的鼻孔中的原因。可说明分子总是在不断运动着。
(3)NH3·H2O是由NH4+、OH-构成的碱,可与酸反应生成盐和水。所以NH3·H2O与稀H2SO4反应的化学方程式为2 NH3·H2O +H2SO4=(NH4)2SO4+2H2O。
(4)氨气本身不是酸或碱,不能使有酚酞变色,所以可观察到有酚酞的干燥纸条不变色。氨气可与水反应生成呈碱性的氨水,碱可使酚酞变红色。所以可观察到有酚酞的湿润纸条会变红色。 (5)根据题意可知:反应物为NH3和O2;生成物为NO和H2O。所以反应的化学方程式为:4NH3+5O2一定条件4NO+6H2O。所以该反应中参加反应的NH3与O2的分子个数之比为4∶5。
(5)根据题意可知:反应物为NH3和O2;生成物为NO和H2O。所以反应的化学方程式为:4NH3+5O2一定条件4NO+6H2O。所以该反应中参加反应的NH3与O2的分子个数之比为4∶5。
考点:碱的性质、化学方程式的书写及意义

根据复分解反应发生的条件,判断稀硫酸与下表中的四种化合物的溶液之间能否发生反应,将表中内容补充完整.
| | 氢氧化钠溶液 | 氯化钠溶液 | 碳酸钾溶液 | 硝酸钡溶液 |
| 稀硫酸 | 能反应 | 不能反应 | 能反应 | |
| 判断依据 | 有水生成 | 没有水、气体、沉淀生成 | | |
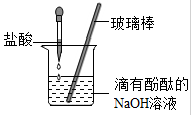
【实验方案】小丽同学设计实验方案进行探究,证明氢氧化钠溶液与稀硫酸发生了反应,请你和她一起完成实验报告.
| 实验操作 | 实验现象 |
| ①向试管中加入约2稀氢氧化钠溶液,滴加2滴 溶液 | |
| ②向①所得液体中滴加过量稀硫酸 | |
【实验拓展】小丽结合所学知识,认为初中常见的酸碱之间一定能发生复分解反应,她判断的依据是 .