题目内容
【题目】过碳酸钠是一种多用途的新型漂白剂,化学式可表示为aNa2CO3·bH2O2,具有Na2CO3和H2O2的双重性质。过碳酸钠溶于水后分解成Na2CO3和H2O2。
(1)以下物质,会使过碳酸钠失效的是_____(填字母)。
A 二氧化锰 B 稀硫酸 C 澄清石灰水 D 氯化钡溶液
(2)测定某样品中过碳酸钠(aNa2CO3·bH2O2)的化学式,以及样品中过碳酸钠的纯度的实验步骤如下(样品中的杂质不参加反应):
步骤1:称取样品0.7g于锥形瓶中,加足量的水溶解,再滴加溶质质量分数为4.9%的稀硫酸8.000g,恰好完全反应。
步骤2:称取样品0.7g于锥形瓶中,加足量的水溶解,再加入1g二氧化锰,反应后收集得到气体67.20mL(该条件下氧气的密度为1.429g/L)。
①步骤1中发生的化学反应方程式为_____。实验室配制100g溶质质量分数为4.9%的稀硫酸,需要溶质质量分数为98%的浓硫酸_____mL(精确到0.1mL)(该条件下浓硫酸的密度为1.84g/mL);配制时需要用到的仪器有量筒、烧杯、玻璃棒_____,配制该稀硫酸应选择的量筒量程(水的密度为1g/mL)有_____(填字母)。
A 5mL B 20mL C 100mL D 200mL
②步骤2中发生的化学反应方程式为_____,如果没有冷却到室温就读取气体的体积,则过碳酸钠化学式中a∶b的测定结果将_____(填“偏大”“偏小”或“无影响”)。
③通过计算,确定该过碳酸钠化学式为_____。
④通过计算,确定该样品中过碳酸钠的纯度为_____。(精确到0.1%)
【答案】ABCD Na2CO3+H2SO4=Na2SO4+H2O+CO2↑ 2.7 胶头滴管 AC 2H2O2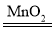 2H2O+O2↑ 偏小 4Na2CO3·3H2O2 89.7%
2H2O+O2↑ 偏小 4Na2CO3·3H2O2 89.7%
【解析】
(1)以下物质,会使过碳酸钠失效的是:
A、二氧化锰能催化过氧化氢分解,使其失效;
B、稀硫酸能与碳酸钠反应产生硫酸钠溶液和二氧化碳气体,使其失效;
C、澄清石灰水能与碳酸钠反应产生碳酸钡沉淀,使其失效;
D、氯化钡溶液能与碳酸钠反应产生碳酸钡沉淀,使其失效;
故选:ABCD。
(2)
①步骤1中碳酸钠与稀硫酸反应产生硫酸钠、水和二氧化碳的化学反应方程式为Na2CO3+H2SO4=Na2SO4+H2O+CO2↑。实验室配制100g溶质质量分数为4.9%的稀硫酸,需要溶质质量分数为98%的浓硫酸质量=![]() ,需要浓硫酸的体积=
,需要浓硫酸的体积=![]() ;配制时需要用到的仪器有量筒、烧杯、玻璃棒和胶头滴管(用于定容),需要水的质量=100g-5g=95g,则需要水的体积=
;配制时需要用到的仪器有量筒、烧杯、玻璃棒和胶头滴管(用于定容),需要水的质量=100g-5g=95g,则需要水的体积=![]() ;配制该稀硫酸应选择的量筒量程有(量筒量程应稍大于液体体积):
;配制该稀硫酸应选择的量筒量程有(量筒量程应稍大于液体体积):
A 5mL,用于量取2.7mL的浓硫酸;
C 100mL,用于量取95 mL的水;
故选:AC。
②步骤2中过氧化氢在二氧化锰催化作用下产生水和氧气的化学反应方程式为 2H2O2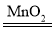 2H2O+O2↑,如果没有冷却到室温就读取气体的体积,则测定过氧化氢产生的氧气体积偏大,则导致过碳酸钠化学式中a∶b的测定结果将偏小。
2H2O+O2↑,如果没有冷却到室温就读取气体的体积,则测定过氧化氢产生的氧气体积偏大,则导致过碳酸钠化学式中a∶b的测定结果将偏小。
③解:设0.7g样品中碳酸钠的质量为x。
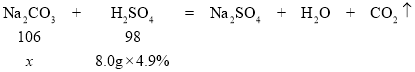
![]() x=0.424g
x=0.424g
设:7.0g中过氧化氢的质量为y。
产生氧气的质量=0.0672L×1.429g/L![]() 0.096g;
0.096g;
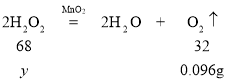
![]() y=0.204g
y=0.204g
则碳酸钠与过氧化氢的分子个数比![]() ;
;
通过计算,确定该过碳酸钠化学式为:4Na2CO3·3H2O2;
④通过计算,确定该样品中过碳酸钠的纯度=![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
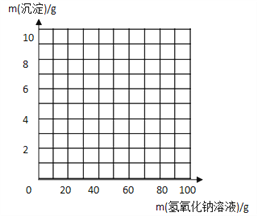
小学生10分钟应用题系列答案【题目】实验室现有硫酸镁和硫酸钠的固体混合物样品,小明同学想测定样品中硫酸镁的质量分数,先称取该混合物样品20g,完全溶于100g水中。然后取用了一定溶质质量分数的氢氧化钠溶液100g平均分四次加入其中,充分振荡,实验所得数据见下表,请你分析并进行有关计算:
次数 | 1 | 2 | 3 | 4 |
加入氢氧化钠溶液的质量/g | 25 | 25 | 25 | 25 |
生成沉淀的质量/g | 2.9 | X | 8.7 | 8.7 |
(1)上表中X的数值为______;原固体混合物样品中硫酸镁的质量分数是 ;
(2)求恰好完全反应时,溶液中溶质的质量分数。(结果精确到0.1%)
(3)请在下图中画出在20 g 样品中加氢氧化钠溶液的质量与产生沉淀质量变化关系的示意图。
(4)若用氢氧化钡溶液代替氢氧化钠溶液来测定样品中硫酸镁的质量分数,是否可行?并说明理由。