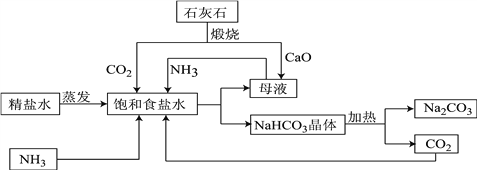
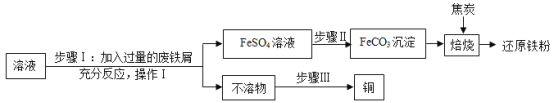
题目内容
【题目】二维价类图可有效帮助我们建立物质之间的联系,高效进行化学学习。
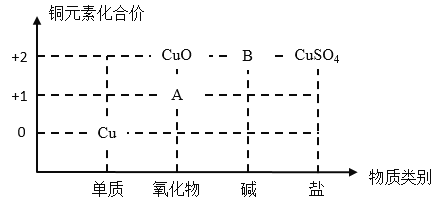
(1)铜单质常用作制电线,这体现了铜的_____性;区分铁丝和铜丝,最简单的方法是_____。
(2)图中物质A的化学式为_____;高温条件下,氧化铜会分解为A和一种常见的气体,写出该反应的化学方程式_____。
(3)图中物质B的化学式为_____,颜色为_____色。CuO可否通过一步反应,转化为CuSO4_____(填“能”或“不能”)。写出一种相对分子质量与B相等的酸与B反应的化学方程式_____,属于_____(填基本反应类型)。
(4)常用无水硫酸铜粉末检验水蒸气,该过程发生的是_____(填“物理变化”或“化学变化”)。
(5)实验室中经常用碳酸钠溶液与硫酸铜溶液制备产品——碱式碳酸铜,反应为:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+2_____+CO2↑。反应时若有少量3Cu(OH)2·CuCO3生成,则产品中铜元素的质量分数_____。(填“偏大”“不变”或“偏小”)
【答案】导电 观察颜色(其他答案不给分) Cu2O 4CuO![]() 2Cu2O+O2↑ Cu(OH)2 蓝 能 Cu(OH)2+H2SO4=CuSO4+2H2O(写与磷酸反应的化学方程式也给分) 复分解反应 化学变化 Na2SO4 偏大
2Cu2O+O2↑ Cu(OH)2 蓝 能 Cu(OH)2+H2SO4=CuSO4+2H2O(写与磷酸反应的化学方程式也给分) 复分解反应 化学变化 Na2SO4 偏大
【解析】
(1)铜单质常用作制电线,这体现了铜的电阻率低,导电性好;区分铁丝和铜丝的最简单方法是:观察颜色,铜丝是紫红色(或红色),铁丝是银白色;
(2)物质A属于氧化物,且铜的化合价为+1价,化学式为Cu2O;高温条件下,氧化铜会分解为氧化亚铜和氧气,该反应的化学方程式:4CuO![]() 2Cu2O+O2↑;
2Cu2O+O2↑;
(3)物质B属于碱类,化学式为Cu(OH)2,为蓝色固体。氧化铜能与硫酸反应生成硫酸铜和水,CuO能通过一步反应,转化为CuSO4。氢氧化铜的相对分子质量为98,硫酸的相对分子质量为98;氢氧化铜与稀硫酸反应产生硫酸铜和水的化学方程式:Cu(OH)2+H2SO4=CuSO4+2H2O,该反应符合“两交换、不变价”,属于复分解反应。
(4)常用无水硫酸铜粉末检验水蒸气,白色无水硫酸铜遇水产生五水硫酸铜(CuSO4·5H2O)晶体,有新物质产生,该过程发生的是化学变化。
(5)实验室中经常用碳酸钠溶液与硫酸铜溶液制备产品——碱式碳酸铜,该反应符合质量守恒定律:反应物比生成物多4个钠原子、2个硫原子和8个氧原子,则反应为:2CuSO4+2Na2CO3+H2O=Cu2(OH)2CO3↓+2Na2SO4+CO2↑。反应时若有少量3Cu(OH)2·CuCO3生成,3Cu(OH)2·CuCO3中铜元素质量分数大于Cu(OH)2CO3;则产品中铜元素的质量分数偏大。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】西藏“茶马古道”芒康县盐井是香格里拉唯一的产盐区。盐田是用紫红色粘土抹平压实的晒盐池,当地人把卤水注入盐田中经过日晒风吹,就得到上等且味道很好的红盐。为揭密红盐呈红色的原因,实验小组进行了如下探究活动。
(提出问题)红盐中存在什么物质使盐呈现红色?
(查找资料)
1、西藏紫红色粘土中含大量的氧化铁(Fe2O3)。
2、溶液中三价铁离子(Fe3+)遇到硫氰化钾(KSCN)溶液,溶液变为血红色。
(作出猜想)红盐中含少量的氧化铁使盐呈现红色;
(实验探究)小组同学从一定量的红盐中提取少量红色粉末,进行如下实验:
实验操作 | 实验现象 | 实验解释与结论 | |
实验I | 步骤①:取少量红色粉末于试管中,滴加适量稀盐酸; | 红色粉末恰好全部溶解; | 红色粉末中含有_____;步骤①涉及的反应的化学方程式_____ |
步骤②:往①所得溶液中滴入硫氰化钾(KSCN)溶液。 | 溶液变为血红色 | ||
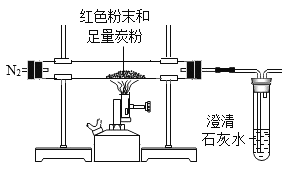
实验Ⅱ | 步骤①:如图所示,将红色粉末与足量的黑色炭粉混合均匀,装入玻璃管中,先通一段时间氮气,再加热。
| 一定时间后,观察到澄清石灰水变浑浊,红色粉末变黑色 | 反应产生的气体为_____;红色粉末中一定含_____元素 |
步骤②:冷却后,取出玻璃管中黑色粉末,将磁铁靠近黑色粉末 | 黑色粉末部分被吸引 | 红色粉末中一定含_____元素 |
(实验结论)猜想_____(填写“正确”或“错误”)。
(实验反思)实验Ⅱ中能否用CO气体代替黑色炭粉并说明理由_____。