题目内容
【题目】下图甲、乙、丙三个方框中为某化学反应的微观示意图,下列说法中不正确的是


A.甲框中组成物质的两种元素质量比为1:1
B.在该反应中甲、乙两框物质质量比为4:1
C.丙框中的物质属于混合物
D.该反应既不是化合反应也不是分解反应
【答案】D
【解析】
由化学反应的微观示意图可知,各物质反应的微粒个数关系是:
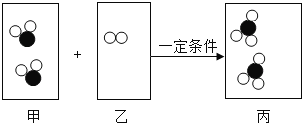 ,由上图可知,该反应是二氧化硫和氧气在一定条件下反应生成了三氧化硫,反应的化学方程式是:2SO2+O2
,由上图可知,该反应是二氧化硫和氧气在一定条件下反应生成了三氧化硫,反应的化学方程式是:2SO2+O2 2SO3。
2SO3。
A、由微粒的构成可知,甲是SO2,甲框中组成物质的两种元素质量比为32:(16×2)=1:1故A说法正确;
B、由化学方程式可知,在该反应中甲、乙两框物质量比为(2×64):32=4:1,故B说法正确;
C、由微粒的变化可知,丙框中有两种物质,属于混合物,故C说法正确;
D、该反应由两种物质生成了一种物质,属于化合反应,故D说法不正确。
故选D。

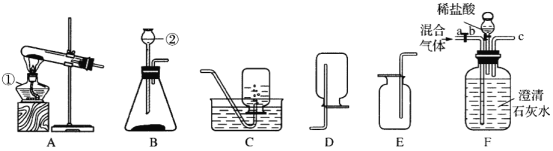
【题目】(4分)合理运用燃烧与灭火的化学原理对保障生命财产安全非常重要。
(1)2013年12月广州建业大厦发生严重火灾。从燃烧条件分析,大厦内存放的大量鞋、纸箱等物品充当了________________。
(2)高层建筑物通常设计了灭火用的洒水系统。从灭火原理分析,洒水的作用主要是______________。
(3)分析下表中的数据,回答问题:
物质代号 | L | M | N | P |
熔点/℃ | -117 | 3550 | 44 | -259 |
沸点/℃ | 78 | 4827 | 257 | -253 |
着火点/℃ | 510 | 370 | 40 | 580 |
①有人认为“物质的熔、沸点越高,着火点越高”,该结论_______________(填“合理”或“不合理”)。

②已知酒精灯火焰的温度约为500℃。利用上图装置,验证达到可燃物着火点是燃烧的条件之一,上表中可用于完成该实验的两种可燃物是_________和________(填代号)。
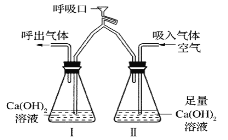
【题目】某学习小组对实验室制取二氧化碳及二氧化碳的性质进行如下两个方面的探究。
(一)第一小组用下图一所示装置制取二氧化碳并测定生成二氧化碳的体积,实验开始时他们通过分液漏斗将20mL稀盐酸快速全部加入锥形瓶中并关闭活塞。并记录量筒中水的体积,数据如下表:
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
量筒读数/ml | 40 | 50 | 55 | 58 | 60 | 60 |
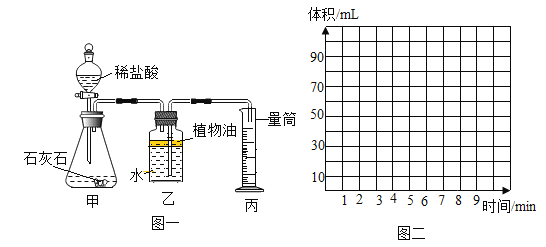
(1)写出图一甲中发生反应的化学方程式_________。
(2)图一丙中量筒最好选_________(选填:“50mL”或“100mL”或“150mL”)。
(3)图一乙中如果不加植物油会使测定结果_____(选填:“偏大”或“偏小").
(4)根据以上实验数据分析,最终生成二氧化碳的体积是_______mL.
(5)在图二中绘出0~6min内生成二氧化碳体积随时间变化的曲线。____
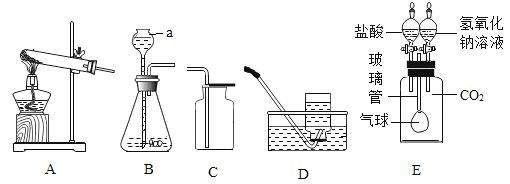
(二)第二小组用下图装置验证二氧化碳有关性质。
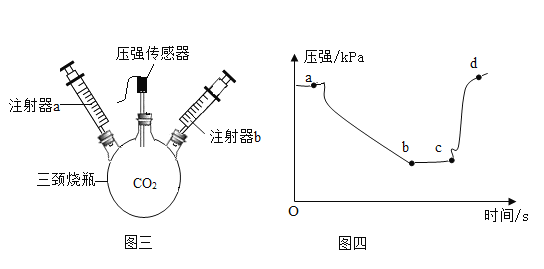
实验步骤:
①连接好装置,向外拉动任一注射器的活塞,一段时间后松开手,活塞回到原处;
②注射器a中吸入20mL澄清石灰水,注射器b中吸入20mL盐酸,连接在如图位置,再从中间瓶口通入二氧化碳气体将瓶装满,最后塞上带压强传感器的橡胶塞;
③先后将两注射器中试剂快速全部推入三颈烧瓶中,并保持注射器活塞在注射器底部,振荡三颈烧瓶,压强传感器测得三颈烧瓶中压强变化如图四。
(1)实验步骤中第①步的目的是_________。
(2)在第②步中如何检验三颈烧瓶中已充满二氧化碳气体__________。
(3)在第③步中最先推入三颈烧瓶的试剂是_____________,这时三颈烧瓶中发生反应的化学方程式是_____________。
(4)在第③步中第二次推入试剂后三颈烧瓶中出现的现象是__________,这时三颈烧瓶中压强变化对应于图四中的哪一段________。