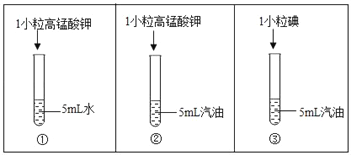
题目内容
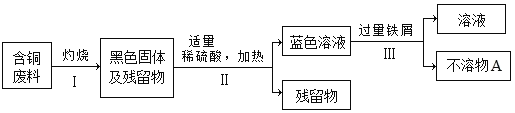
【题目】查阅资料得知:Cu可与浓硫酸在加热的条件下反应,化学方程式为Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2R,利用如图装置可以完成该实验(不考虑水分蒸发),下列说法中不正确的是( )
CuSO4+SO2↑+2R,利用如图装置可以完成该实验(不考虑水分蒸发),下列说法中不正确的是( )
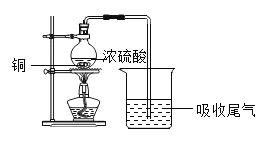
A. 反应后,烧瓶中减少的质量与烧杯中增加的质量相等
B. 该反应不属于分解反应
C. 反应前后,H2SO4中的化合价有发生改变
D. R一定含有氢、氧两种元素,可能含有硫元素
【答案】D
【解析】
A、反应后,二氧化硫被烧杯中的物质吸收,因此烧瓶中减少的质量与烧杯中增加的质量相等,故选项正确;
B、该反中反应物是两种,应不属于分解反应,故选项正确;
C、反应前后,H2SO4中的化合价有发生改变,硫酸中硫元素化合价是+6,二氧化硫中硫元素化合价是+4,故选项正确;
D、由Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2R可知,反应前后铜原子都是1个,硫原子都是2个,反应前氢原子是4个,反应后应该是4个,包含在2R中,反应前氧原子是8个,反应后应该是8个,其中2个包含在2R,R是水,即R一定含有氢、氧两种元素,不含有硫元素,故选项不正确。故选D。
CuSO4+SO2↑+2R可知,反应前后铜原子都是1个,硫原子都是2个,反应前氢原子是4个,反应后应该是4个,包含在2R中,反应前氧原子是8个,反应后应该是8个,其中2个包含在2R,R是水,即R一定含有氢、氧两种元素,不含有硫元素,故选项不正确。故选D。

【题目】“五一”假期,小兵对“锌与硫酸反应快慢的影响因素”进行了探究。
【提出问题】锌与硫酸反应的快慢受哪些因素的影响呢?
【猜想与假设】a.可能与硫酸的质量分数有关;
b.可能与锌的形状有关。
【设计并实验】小兵用不同质量分数的硫酸和不同形状的锌进行如下实验。
实验 编号 | 硫酸的质量 分数(均取 20 mL) | 锌的形状 (均取1 g) | 氢气的体积(mL) (均收集3分钟) |
① | 20% | 锌粒 | 31.7 |
② | 20% | 锌片 | 50.9 |
③ | 30% | 锌粒 | 61.7 |
④ | 30% | 锌片 | 79.9 |
(1)写出稀硫酸与锌反应的化学方程式:________________________。
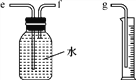
(2)小兵用如图所示装置收集并测量氢气的体积,其中量筒的作用是________________________________________,氢气应从________(填“e”“f”或“g”)管通入。
【收集证据】(3)要比较不同质量分数的硫酸对反应快慢的影响,应选择的实验编号是____________。
【得出结论】(4)结论是________________________________________________________________。
(5)下表是小兵第①组实验的详细数据。
时段(均 为1分钟) | 第1 分钟 | 第2 分钟 | 第3 分钟 | 第4 分钟 | 第5 分钟 | 第6 分钟 |
H2的体积 | 3.1 mL | 16.7 mL | 11.9 mL | 9.6 mL | 7.6 mL | 6.0 mL |
请描述锌与硫酸反应的快慢的变化并解释原因:______________________________。
(6)锌与硫酸反应的快慢可能还受哪些因素影响?设计实验验证。___________________。